
题目列表(包括答案和解析)
人们对苯及芳香烃的认识有一个不断深化的过程。
(1)由于苯的含碳量与乙炔相同,人们认为它是一种不饱和烃,写出分子式为C6H6 的一种含两个三键且无支链链烃的结构简式
(2)已知分子式为C6H6 的结构有多种,其中的两种为

①这两种结构的区别表现在:
A.化学性质方面:(Ⅱ)能 (选填a、b、c、d,多选扣分)而(Ⅰ)不能
a、被酸性高锰酸钾溶液氧化 b、能与溴水发生加成反应,
c、能与溴发生取代反应 d、能与氢气发生加成反应
B.消耗反应物的量的方面:1 mol C6H6 与H2加成时:
(Ⅰ)需______mol,而(Ⅱ)需_______mol
②今发现C6H6还可能有另一种如右图立体结构: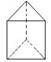 ,该结构的二氯代物有____种
,该结构的二氯代物有____种
“绿色化学”要求在化工合成过程中,目标产物对反应物的原子利用率达到100%,下列反应类型最符合这一要求的是
A.取代反应 B.加聚反应
C.氧化反应 D.消去反应
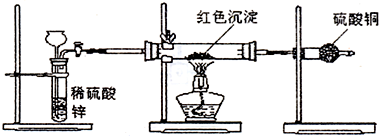
 I.高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
I.高炉炼铁是冶炼铁的主要方法,发生的主要反应为:| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
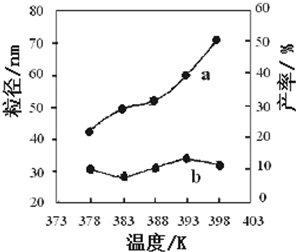
| 编号 | 温度/K | 反应时间/h | 反应物物质的量配比 | 实验目的 |
| ① | 378 | 3 | 3:1 | 实验②和④探究 实验②和 |
| ② | 378 | 4 | 4:1 | |
| ③ | 378 | 3 | ||
| ④ | 398 | 4 | 4:1 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com