
题目列表(包括答案和解析)
(1)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能的杂质是__________。它是由________________而产生的。如果滤液中该杂质的含量不是很低,其检测方法是________________________________。
(2)设Na2SO3跟硫粉完全反应,将滤液蒸发浓缩后,冷却至70 ℃,溶液的体积约为30 mL,该溶液是否达到饱和?试通过计算说明。(70 ℃时,Na2S2O3饱和溶液的密度为1.17 g·cm-3)
(3)若要计算在100 ℃下将溶液蒸发至体积为30.0 mL,再冷却至10 ℃所能得到的Na2S2O3·5H2O的质量,你认为__________(填写1个选项字母)。
A.前面提供的数据已经足够
B.还需要提供100 ℃时溶液的密度(1.14 g·cm-3)
C.还需提供结晶后剩余溶液体积(10.0 mL)
(4)根据第(3)小题的选择(如选A项则直接计算,如选B项或C项则可选用其数据计算),计算从10 ℃ 30.0 mL溶液中结晶析出的Na2S2O3·5H2O质量。
(16分)用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3。10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g。常温下,从溶液中析出的晶体是Na2S2O3?5H2O。Na2S2O3在酸性溶液中立即完全分解:
Na2S2O3+2HCl=S↓+SO2↑+H2O+2NaCl
现取15.1gNa2SO3,溶于80.0mL水。另取5.00g硫粉,用少许乙醇润湿后(以便硫能被水浸润),加到上述溶液中。用小火加热至微沸,反应约1h后过滤。滤液在100℃经蒸发、浓缩、冷却至10℃后析出Na2S2O3?5H2O晶体。
⑴若加入的硫粉不用乙醇润湿,对反应的影响是 。(填写选项的字母,可以多选,但选错要倒扣。)
A.会降低反应速率 B.需要提高反应温度
C.将增大反应体系的pH值 D.会减少产量
⑵反应1h后过滤,其目的是 。
⑶滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是 。它是由 而产生的。如果滤液中该杂质的含量不很低,其检测的方法是: 。
⑷设Na2SO3跟硫粉完全反应,当将滤液蒸发浓缩后,冷却至70℃,溶液的体积约30mL,该溶液是否达到饱和?试通过计算说明。(70℃时,Na2S2O3饱和溶液的密度为1.17g/cm3)
⑸若要计算在100℃下将溶液蒸发至体积为30.0mL,再冷却至10℃时所能得到的Na2SO3?5H2O的质量,你认为 。(填写一个选项的字母)
A.前面提供的数据已经足够。
B.还需要提供100℃时溶液的密度(1.14g/cm3)。
C.还需要提供结晶后剩余溶液的体积(10.0mL)。
⑹根据第(5)小题你的选择(如选A则直接计算,如选B或C则可选用其数据),计算从10℃、30.0mL溶液中结晶而出的Na2S2O3?5H2O的质量。
(20分)MnO2是一种重要的功能无机材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(只含有较多的MnO和MnCO3)样品转化为纯MnO2的实验,其流程如下:
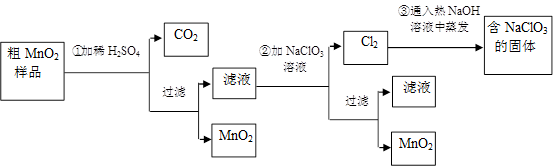
(1)第①步加稀H2SO4时,将粗MnO2样品中 ▲ ,▲ (写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式是(补充完整并配平): Mn2+ + ClO3—+ = MnO2↓+ Cl2↑+ ;
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、 ▲ 、 ▲ 、玻璃棒。
(4)若粗MnO2样品的质量为12.69g,第①步反应后,经过滤得到8.7g MnO2,并收集到0.224LCO2(标准状况下),则在第①步反应中至少需要▲ mol H2SO4。写出计算过程 (已知摩尔质量:MnO2 -87g/mol; MnO-71g/mol; MnCO3-115g/mol)
(5)已知2H2O2(l)=2H2O(l)+O2(g) △H=a kJ·mol-1 反应过程的能量变化如图所示。则
① 该反应为 ▲ 反应(填“吸热”或“放热”)。
②请用虚线在右图中画出使用MnO2作催化剂的情况下反应过程中体系能量变化示意图。

(9分)12000年前,地球上发生过一次大灾变,气温骤降,导致猛犸灭绝,北美Clovis文化消亡。有一种假说认为,灾变缘起一颗碳质彗星撞击地球。2010年几个研究小组发现,在北美和格林兰该地质年代的地层中存在超乎寻常浓度的纳米六方金刚石,被认为是该假设的证据。
7-1 立方金刚石的晶胞如图7-1所示。画出以两个黑色碳原子为中心的C—C键及所连接的碳原子。

7-2 图7-2上、下分别是立方金刚石和六方金刚石的碳架结构。它们的碳环构型有何不同?
7-3 六方硫化锌的晶体结构如图7-3所示。用碳原子代替硫原子和锌原子,即为六方金刚石。请在该图内用粗线框出六方金刚石的一个晶胞,要求框线必须包含图中已有的一段粗线,且框出的晶胞体积最小。
7-4 立方金刚石中周期性重复的最小单位包含 个碳原子。
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.无色溶液中:K+、H+、Fe2+、NO3- |
| B.c(H+)<c(OH-)的溶液中:Na+、K+、SO42-、ClO- |
| C.含0.1mol·L-1 HCO3-的溶液中:Al3+、Ca2+、NO3-、SO42- |
| D.含0.1 mol·L-1 SCN-的溶液中:Fe3+、NH4+、NO3-、Cu2+ |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com