
题目列表(包括答案和解析)
(6分)由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。
(1)在250C、101KPa时,3.2克甲醇(CH30H)完全燃烧生成CO2和液态水时放热72.576kJ,则能表示甲醇燃烧的热化学方程式为___________________。
(2)为探究反应原理,现进行如下实验,在体积为2 L的密闭容器中,充入2mol CO2和6mol H2,一定条件下发生反应:CO2(g)+3H2(g)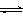 CH3OH(g)+H2O(g) △H=—49kJ/mol,测得CO2和H2O (g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) △H=—49kJ/mol,测得CO2和H2O (g)的浓度随时间变化如图所示。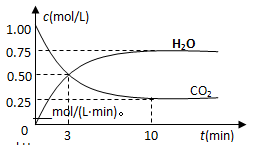
①从反应开始到平衡,氢气的平均反应速率v(H2)=__________mol/(L·min)。
②下列措施中能使n(H2O)/n(CO2)增大的是________。
A.升高温度 B.再充入3mol H2
C.将CH3OH (g)从体系中分离 D.充入He(g),使体系压强增大
(6分)由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。
(1)在250C、101KPa时,3.2克甲醇(CH30H)完全燃烧生成CO2和液态水时放热72.576kJ,则能表示甲醇燃烧的热化学方程式为___________________。
(2)为探究反应原理,现进行如下实验,在体积为2 L的密闭容器中,充入2mol
CO2和6mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=—49kJ/mol,测得CO2和H2O
(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) △H=—49kJ/mol,测得CO2和H2O
(g)的浓度随时间变化如图所示。

①从反应开始到平衡,氢气的平均反应速率v(H2)=__________mol/(L·min)。
②下列措施中能使n(H2O)/n(CO2)增大的是________。
A.升高温度 B.再充入3mol H2
C.将CH3OH (g)从体系中分离 D.充入He(g),使体系压强增大
(6分)由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。
(1)在250C、101KPa时,3.2克甲醇(CH30H)完全燃烧生成CO2和液态水时放热72.576kJ,则能表示甲醇燃烧的热化学方程式为___________________。
(2)为探究反应原理,现进行如下实验,在体积为2 L的密闭容器中,充入2molCO2和6mol H2,一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H=—49kJ/mol,测得CO2和H2O(g)的浓度随时间变化如图所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)=__________mol/(L·min)。
②下列措施中能使n(H2O)/n(CO2)增大的是________。
A.升高温度 B.再充入3mol H2
C.将CH3OH(g)从体系中分离 D.充入He(g),使体系压强增大
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。
(1)在250C、101KPa时,3.2克甲醇(CH30H)完全燃烧生成CO2和液态水时放热72.576kJ,
 则能表示甲醇燃烧的热化学方程式为___________________。
则能表示甲醇燃烧的热化学方程式为___________________。
(2)为探究反应原理,现进行如下实验,在体积
为2 L的密闭容器中,充入2mol CO2和6mol H2,一
定条件下发生反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=—49kJ/mol
CH3OH(g)+H2O(g) △H=—49kJ/mol
测得CO2和H2O (g)的浓度随时间变化如图所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)=__________mol/(L·min)。
②下列措施中能使n(H2O)/n(CO2)增大的是________。
A.升高温度 B.再充入3mol H2
C.将CH3OH (g)从体系中分离 D.充入He(g),使体系压强增大
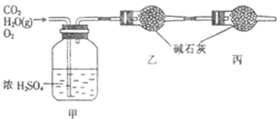
| 实验前 | 实验后 | |
| 甲的质量/g | 101.1 | 103.8 |
| 乙的质量/g | 82.0 | 86.4 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com