
题目列表(包括答案和解析)
(15分)氨气是一种重要的化工原料,大量用于制造尿素、纯碱、铵态氮肥以及硝酸,在有机合成工业中制合成纤维、塑料、染料等。请回答下列问题:
(1)氨气是工业制备硝酸的重要原料,已知下列三个热化学方程式:
① N2 (g)+ 3H2
(g)  2NH3 (g) △H1
2NH3 (g) △H1
② 4NH3(g) +5O2 (g)= 4NO(g) +6H2O(l) △H2
③ N2 (g)+ O2 (g)= 2NO (g) △H
能否应用△H1和△H2表示△H?
若能用△H1和△H2表示△H,则写出△H= ;若不能,说明理由:
。
(2)在相同的温度下,容积相等的两个恒容密闭容器(编号分别为a和b)中,一定量的氮气和氢气发生下列可逆反应:
N2(g)
+ 3H2(g)
 2NH3(g) △H=-92.4 kJ/mol
2NH3(g) △H=-92.4 kJ/mol
实验测得反应起始时各物质的物质的量及平衡时放出的热量如下表:
|
容器编号 |
起始时各物质物质的量/mol |
平衡时反应 |
||
|
N2 |
H2 |
NH3 |
||
|
a |
1 |
3 |
0 |
23.1 |
|
b |
2 |
6 |
0 |
未知(用E表示) |
下列说法正确的是 (填序号)
① 反应a和反应b的氢气转化率相同
②利用已知数据可以计算反应b的平衡常数
③利用已知数据可以计算反应b放出的能量E
④平衡时a、b两个反应的氨气体积分数为1:1
(3)温度为400℃、压强为30Mpa的情况下,密闭容器中发生氢气与氮气的合成氨反应:N2(g)+3H2(g)  2NH3(g)
△H<0 。
2NH3(g)
△H<0 。
氨气的物质的量[n(NH3)]和氢气的物质的量[n(H2)]随时间变化的关系如下图:

正反应速率最大的点是 (选填a、b、c、d中的一个或几个),氮气的物质的量[n(N2)]相等的两点是 (选填a、b、c、d中的两个);保持其他条件不变,将温度改为600℃,在上图中画出反应达到平衡的过程中氨气的变化曲线。
(4)工业合成氨用煤制备原料气氢气时,往往排放大量的二氧化碳。实际工业生成中可利用二氧化碳联合生产二甲醚(CH3OCH3),一定条件下,在容积固定的密闭设备中发生反应:
2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H<0
CH3OCH3(g)+3H2O(g) △H<0
两个密闭恒容容器中在温度均为T且保持不变的情况下进行上述反应,一段时间后测得两个容器中有关数据及正逆反应速率关系如下表:
|
容器 |
c(CO2) /mol·L-1 |
c(H2) /mol·L-1 |
c(CH3OCH3) /mol·L-1 |
c(H2O) /mol·L-1 |
v (正)和v (逆)比较 |
|
容器I |
1.0×10-2 |
1.0×10-2 |
1.0×10-4 |
1.0×10-4 |
v (正)=v (逆) |
|
容器II |
2.0×10-2 |
1.0×10-2 |
1.0×10-4 |
2.0×10-4 |
|
容器I中的反应 (选填“是”或“否”)达到平衡状态,该反应在温度为T时的平衡常数K= 。表格内的空格处v(正)与v(逆)的大小关系是 。
(6分)如图所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1∶4)的混合气体,假定氯气在水中的溶解度可以忽略。将封闭有甲烷和氯气的混合气体的装置放置在有光亮的地方,让混合气体缓慢地反应一段时间。

(1) 假设甲烷与氯气反应充分,且只产生一种有机物,
请写出化学方程式:
_____________________________________________________。
(2)若题目中甲烷与氯气的体积比为1∶1,则得到的产物为________。
A.CH3Cl HCl
B.CCl4 HCl
C.CH3Cl CH2Cl2
D.CH3Cl CH2Cl2 CHCl3 CCl4 HCl
(3)经过几个小时的反应后,U形管右端的水柱变化是
________________________________________________________________________。
A.升高 B.降低 C.不变 D.无法确定
(4)若水中含有Na2SiO3,则在U形管左端会观察到
________________________________________________________________________。
(5)右端玻璃管的作用是______________________________________。
(6分)如图所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1∶4)的混合气体,假定氯气在水中的溶解度可以忽略。将封闭有甲烷和氯气的混合气体的装置放置在有光亮的地方,让混合气体缓慢地反应一段时间。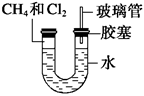
(1)假设甲烷与氯气反应充分,且只产生一种有机物,
请写出化学方程式:
_____________________________________________________。
(2)若题目中甲烷与氯气的体积比为1∶1,则得到的产物为________。
A.CH3Cl HCl
B.CCl4 HCl
C.CH3Cl CH2Cl2
D.CH3Cl CH2Cl2 CHCl3 CCl4 HCl
(3)经过几个小时的反应后,U形管右端的水柱变化是
________________________________________________________________________。
A.升高 B.降低 C.不变 D.无法确定
(4)若水中含有Na2SiO3,则在U形管左端会观察到
________________________________________________________________________。
(5)右端玻璃管的作用是______________________________________。
(15分)氨气是一种重要的化工原料,大量用于制造尿素、纯碱、铵态氮肥以及硝酸,在有机合成工业中制合成纤维、塑料、染料等。请回答下列问题:
(1)氨气是工业制备硝酸的重要原料,已知下列三个热化学方程式:
① N2 (g)+ 3H2 (g) 2NH3 (g) △H1
2NH3 (g) △H1
② 4NH3(g) +5O2 (g)= 4NO(g) +6H2O(l) △H2
③ N2 (g)+ O2 (g)= 2NO (g) △H
能否应用△H1和△H2表示△H?
若能用△H1和△H2表示△H,则写出△H= ;若不能,说明理由:
。
(2)在相同的温度下,容积相等的两个恒容密闭容器(编号分别为a和b)中,一定量的氮气和氢气发生下列可逆反应:
N2(g) + 3H2(g)  2NH3(g) △H=-92.4 kJ/mol
2NH3(g) △H=-92.4 kJ/mol
实验测得反应起始时各物质的物质的量及平衡时放出的热量如下表:
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应 | ||
| N2 | H2 | NH3 | ||
| a | 1 | 3 | 0 | 23.1 |
| b | 2 | 6 | 0 | 未知(用E表示) |
 2NH3(g) △H<0 。
2NH3(g) △H<0 。
 CH3OCH3(g)+3H2O(g) △H<0
CH3OCH3(g)+3H2O(g) △H<0| 容器 | c(CO2) /mol·L-1 | c(H2) /mol·L-1 | c(CH3OCH3) /mol·L-1 | c(H2O) /mol·L-1 | v (正)和v (逆)比较 |
| 容器I | 1.0×10-2 | 1.0×10-2 | 1.0×10-4 | 1.0×10-4 | v (正)=v (逆) |
| 容器II | 2.0×10-2 | 1.0×10-2 | 1.0×10-4 | 2.0×10-4 | |
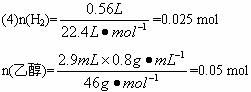
图6-4
(1)若用图6-4中所列仪器和导管组装实验装置,如果所制气体流向从左到右时,仪器和导管连接的顺序是________接________接________接________接________接________。(填编号)
(2)仪器连接好后进行实验时有下列操作:①在仪器C中装入
(3)这样制得的H2中含有什么气体杂质?应该怎样除去?
(4)若实验时消耗2.9 mL无水乙醇(密度为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com