
题目列表(包括答案和解析)
(1)①在50 s内,甲容器中O2的化学反应速率为_____________,甲容器达到平衡时SO2的转化率是_____________。
②乙容器达到平衡时所需时间_____________50 s(填“大于”“小于”或“等于”)。
(2)达到平衡状态后,要使甲、乙两容器中SO2物质的量相等,可采取的措施是_____________(填字母)。
A.保持温度不变,适当扩大甲容器的容积
B.保持容积不变,使乙容器升温
C.保持容积和温度不变,向乙容器中加入适量SO3(g)
D.保持容积和温度不变,向甲容器中加入适量SO3(g)
合成氨对化学工业和国防工业具有重要意义.
(1)
向合成塔中按1∶4的物质的量之比充入N2、H2进行氨的合成,图A为T℃时平衡混合物中氨气的体积分数与压强(P)的关系图.
①写出工业上合成氨的化学方程式________.
②图
A中氨气的体积分数为15.00%时,H2的转化率=________.③图B中T=
500℃,温度为450℃对应的曲线是________(选填字母“a"或“b”),选择的理由是________.④由图像知,增大压强可提高原料的利用率,从生产实际考虑增大压强需解决的问题是________(写出一条即可).
(2)
合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为:![]()
(3)
一定温度下,在2 L容器中发生上述反应,各物质的物质的量变化如下表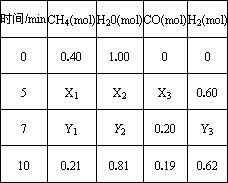
①分析表中数据,判断5~7
min之间反应是否处于平衡状态________(填“是”或“否”),前5 min平均反应速率v(CH4)=________.②反应在7~10
min之间,CO的物质的量减少的原因可能是________(填字母).a.
减少CH4b.
降低温度c.
增大压强d.
充入H2③
若保持温度不变,向1 L容器中起始充入0.15 mol CH4.0.45 mol H2O.________mol CO、________mol H2,达到平衡时CH4的体积百分含量与第一次投料相同.| 时间/物质的量 | n(A)(mol) | n(B)(mol) | n(C)(mol) | n(D)(mol) |
| 起始 | 0.9 | 1.4 | 0 | 0.2 |
| 第1min | 0.6 | 1.1 | 0.15 | |
| 第2min | 0.4 | 0.9 | 0.25 | |
| 第3min | 0.3 | 0.8 | 0.8 | |
| 第4min | 0.3 | 0.8 | 0.3 | 0.8 |
| 第5min | 0.35 | 0.85 | 0.275 | 0.75 |

| ||
| 高温高压 |
| ||
| 高温高压 |
 CO(g)+3H2(g);△H=+QkJ/mol(Q>0)
CO(g)+3H2(g);△H=+QkJ/mol(Q>0)| 时间/min | CH4(mol) | H20( mol) | CO (mol) | H2 (mol) |
| 0 | 0.40 | 1.00 | 0 | 0 |
| 5 | X1 | X2 | X3 | 0.60 |
| 7 | Y1 | Y2 | 0.20 | Y3 |
| 10 | 0.21 | 0.81 | 0.19 | 0.62 |

 CO(g)+3H2(g);△H=+QkJ/mol(Q>0)
CO(g)+3H2(g);△H=+QkJ/mol(Q>0)| 时间/min | CH4(mol) | H20( mol) | CO (mol) | H2 (mol) |
| 0.40 | 1.00 | |||
| 5 | X1 | X2 | X3 | 0.60 |
| 7 | Y1 | Y2 | 0.20 | Y3 |
| 10 | 0.21 | 0.81 | 0.19 | 0.62 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com