
题目列表(包括答案和解析)
1932年,美国化学大师Linus Pauling提出电负性(用希腊字母χ表示)的概念,用来确定化合物中原子某种能力的相对大小。Linus Pauling假定F的电负性为4,并通过热化学方法建立了其他元素的电负性。LinusPauling建立的主族元素的电负性如下:
| H:2.1 |
|
|
|
|
|
|
| Li:1.0 | Be:1.5 | B:2.0 | C:2.5 | N:3.0 | O:3.5 | F:4.0 |
| Na:0.9 | Mg:1.2 | Al:1.5 | Si:1.8 | P:2.1 | S:2.5 | Cl:3.0 |
| K:0.8 | Ca:1.0 | Ga:1.6 | Ge:1.8 | As:2.0 | Se:2.4 | Br:2.8 |
| Rb:0.8 | Sr:1.0 | In:1.7 | Sn:1.8 | Sb:1.9 | Te:χ | I:2.5 |
| Cs:0.7 | Ba:0.9 | Tl:1.8 | Pb:1.9 | Bi:1.9 | Po:2.0 | At:2.2 |
| Fr:0.7 | Ra:0.9 |
|
|
|
|
|
回答下列问题:
⑴纵观各周期主族元素电负性变化,谈谈你对元素性质呈现周期性变化的理解: ;
⑵预测Te元素χ的值 ;
⑶你认为Linus Pauling提出电负性的概念是确定化合物中原子哪种能力的相对大小? ;
⑷大量事实表明,当两种元素的电负性差值小于1.7时,这两种元素通常形成共价化合物。用电子式表示AlBr3的形成过程 。
1932年,美国化学大师Linus Pauling提出电负性(用希腊字母χ表示)的概念,用来确定化合物中原子某种能力的相对大小。Linus Pauling假定F的电负性为4,并通过热化学方法建立了其他元素的电负性。Linus Pauling建立的主族元素的电负性如下:
|
H:2.1 |
|
|
|
|
|
|
|
Li:1.0 |
Be:1.5 |
B:2.0 |
C:2.5 |
N:3.0 |
O:3.5 |
F:4.0 |
|
Na:0.9 |
Mg:1.2 |
Al:1.5 |
Si:1.8 |
P:2.1 |
S:2.5 |
Cl:3.0 |
|
K:0.8 |
Ca:1.0 |
Ga:1.6 |
Ge:1.8 |
As:2.0 |
Se:2.4 |
Br:2.8 |
|
Rb:0.8 |
Sr:1.0 |
In:1.7 |
Sn:1.8 |
Sb:1.9 |
Te:χ |
I:2.5 |
|
Cs:0.7 |
Ba:0.9 |
Tl:1.8 |
Pb:1.9 |
Bi:1.9 |
Po:2.0 |
At:2.2 |
|
Fr:0.7 |
Ra:0.9 |
|
|
|
|
|
回答下列问题:
⑴纵观各周期主族元素电负性变化,谈谈你对元素性质呈现周期性变化的理解: ;
⑵预测Te元素χ的值 ;
⑶你认为Linus Pauling提出电负性的概念是确定化合物中原子哪种能力的相对大小? ;
⑷大量事实表明,当两种元素的电负性差值小于1.7时,这两种元素通常形成共价化合物。用电子式表示AlBr3的形成过程 。
1932年,美国化学大师Linus Pauling提出电负性(用希腊字母χ表示)的概念,用来确定化合物中原子某种能力的相对大小。Linus Pauling假定F的电负性为4,并通过热化学方法建立了其他元素的电负性。Linus Pauling建立的主族元素的电负性如下:
| H:2.1 | ||||||
| Li:1.0 | Be:1.5 | B:2.0 | C:2.5 | N:3.0 | O:3.5 | F:4.0 |
| Na:0.9 | Mg:1.2 | Al:1.5 | Si:1.8 | P:2.1 | S:2.5 | Cl:3.0 |
| K:0.8 | Ca:1.0 | Ga:1.6 | Ge:1.8 | As:2.0 | Se:2.4 | Br:2.8 |
| Rb:0.8 | Sr:1.0 | In:1.7 | Sn:1.8 | Sb:1.9 | Te:χ | I:2.5 |
| Cs:0.7 | Ba:0.9 | Tl:1.8 | Pb:1.9 | Bi:1.9 | Po:2.0 | At:2.2 |
| Fr:0.7 | Ra:0.9 |
回答下列问题:
⑴纵观各周期主族元素电负性变化,谈谈你对元素性质呈现周期性变化的理解: ;
⑵预测Te元素χ的值 ;
⑶你认为Linus Pauling提出电负性的概念是确定化合物中原子哪种能力的相对大小? ;
⑷大量事实表明,当两种元素的电负性差值小于1.7时,这两种元素通常形成共价化合物。用电子式表示AlBr3的形成过程 。
(18分)下列八个步骤是用来分析一种含铅锡的合金中铅和锡的个别含量
(1)称量0.4062g的合金,放在烧杯中,用11mol?L-1的HCl和16mol?L-1的HNO3溶液溶解样品。在此过程中铅和锡分别被氧化成Pb(II)、Sn(VI)。
(2)再加热5分钟,以赶走氮和氯的氧化物后,使溶液冷却;此时会有一些锡化合物和一种铅化合物沉淀出。
(3)加入25.00mL 0.2000mol?L-1的Na2H2EDTA(可用H2Y2-表示)溶液后,沉淀会溶解成一透明无色的溶液。
(4)上述溶液全部移入250.0mL的量瓶中,并用蒸馏水稀释到量瓶的刻度上。
(5)拿出25.00mL,加入30%的Hexamine(如下图)溶液15mL、H2O及两滴的类苯酚橙(以XO代表)(如下图)当指示剂,此溶液的pH值为6。
(6)再用标准0.009970mol?L-1的硝酸铅Pb(NO3)2 溶液滴定从第(5)步骤中的黄色透明的溶液,直至颜色刚好由黄色变到红色,此实验值为24.05mL。
(7)取2.0g的固体NaF加入滴定瓶中,此时溶液会变回黄色。
(8)再用0.009970mol?L-1的硝酸铅滴定到颜色变红,此实验值为15.00mL。
Hexamine和类苯酚橙(XO)的结构式如下:
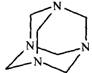
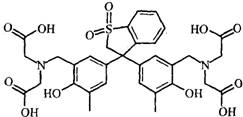
Hexamine 类苯酚橙(XO)
Hexamine的pKb =9.5。类苯酚橙(XO)在pH小于4时是红色,pH大于5时是黄色
回答下列问题
10-1 在步骤(2)中铅的沉淀物是什么?写出其化学式。
10-2 写出步骤(3)中沉淀消失的离子反应方程式(必须平衡)?记得此溶液的pH值为6。
10-3 步骤(5)中为何加入Hexamine?
10-4 加入类苯酚橙(XO)的目的为何?
10-5 写出步骤(6)中,(i)在滴定过程中,以及(ii)滴定终点造成颜色变化时的平衡离子反应方程式。
10-6 步骤(7)中,加入NaF的目的为何?
10-7 写出步骤(7)中的平衡离子方程式。
10-8 用平衡的离子方程式来说明为什么步骤(7)中的颜色会由红变为黄?用XO代表类苯酚橙。
10-9 计算此合金中Pb的重量百分比,再另外计算此合金中Sn的重量百分比。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com