
题目列表(包括答案和解析)
.能用来分离Fe3+和Al3+离子的试剂是( )
A.KSCN B.NH3· H2O C.NaOH溶液 D.H2S溶液
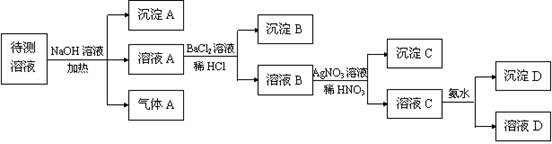
(10分)在某澄清、透明的浅黄色溶液中,可能含有K+、NH4+、Fe3+、Ba2+、Al3+、SO42-、HCO3-、Cl-离子。进行下述实验(所加试剂均过量)。
(1)气体A的化学式是 ,沉淀A的化学式是 ;
(2)待测液中一定存在 ;一定不存在 _______ ;
(3)写出溶液C与过量氨水反应的离子方程式 。
(4)三硅酸镁被用来治疗胃酸过多的胃溃疡,是因为该物质不溶于水,服用后能中和胃酸,作用持久。把三硅酸镁(Mg2Si3O8·nH2O)改写成氧化物的形式为 ,
它中和胃酸(HCl)的离子方程式是: 。
(10分)在某澄清、透明的浅黄色溶液中,可能含有K+、NH4+、Fe3+、Ba2+、Al3+、SO42-、HCO3-、Cl-离子。进行下述实验(所加试剂均过量)。

(1)气体A的化学式是 ,沉淀A的化学式是 ;
(2)待测液中一定存在 ;一定不存在 _______ ;
(3)写出溶液C与过量氨水反应的离子方程式 。
(4)三硅酸镁被用来治疗胃酸过多的胃溃疡,是因为该物质不溶于水,服用后能中和胃酸,作用持久。把三硅酸镁(Mg2Si3O8·nH2O)改写成氧化物的形式为 ,
它中和胃酸(HCl)的离子方程式是: 。
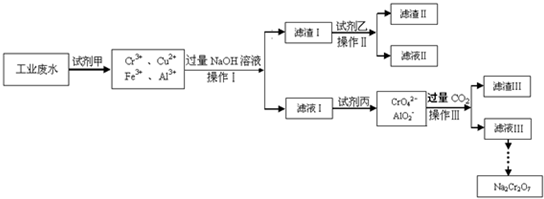
 NaCrO2
NaCrO2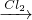 Na2CrO4
Na2CrO4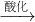 Na2Cr2O7
Na2Cr2O7湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com