
题目列表(包括答案和解析)
(14分)镁、铝是两种重要的金属,它们的单质及化合物有着各自的性质。
Ⅰ.海水中含有氯化镁,是镁的重要来源之一。从海水中制取镁,某同学设计了如下
流程步骤:

主要的步骤总结如下:①把贝壳制成石灰乳 ②往母液中加石灰乳,沉降、过滤,得到Mg(OH)2沉淀 ③将沉淀物与盐酸反应,结晶、过滤,将制得的晶体脱水得无水MgCl2
④将得到的产物熔融后电解。
(1)下列说法不正确的是__________________(填代号)
A.此法的优点之一是原料来源丰富
B.进行①②③步骤的目的是从海水中提取氯化镁
C.第④步电解法制取镁是由于镁是很活泼的金属
D.以上制取镁的过程中涉及的反应有分解反应、化合反应和置换反应
(2)步骤②不够合理,理由是
Ⅱ.(1)铝、空气、海水可组成一种电池,广泛用于制造航标灯。此电池正极的电极反应为 。
(2)铝热还原法是冶炼熔点较高的金属的一种重要方法,焊接钢轨即用到此法。将干燥的氧化铁粉末和铝粉均匀混合后放入纸漏斗中(漏斗已事先处理好),并架在铁架台上,
下面放置一个盛有沙子的蒸发皿。请写出引发铝热反应的操作及该反应的化学方程式:
操作
化学方程式 。
(3)为确定某铝热剂(氧化铁粉末和铝粉)的组成,分别进行下列实验。
若取10.7 g样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况)体积为3.36 L ,反应的化学方程式为 ,样品中铝的质量是 g。
若取10.7 g样品将其点燃,恰好完全反应,待反应产物冷却后,加入足量盐酸,测得生成的气体体积为a L,该气体与上小题中所得气体的体积比等于 ∶ 。
(12分)综合利用海水可以制备食盐、纯碱、金属镁、溴等物质,其流程如下图所示:
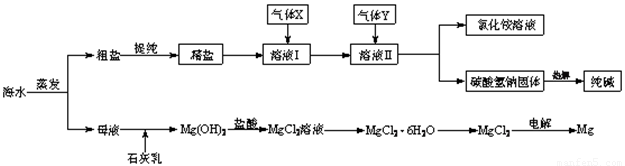
(1)粗盐中含有硫酸钠、氯化镁、氯化钙等可溶性杂质,为除去这些杂质而得精盐,进行如下操作:①溶解;②加过量的BaCl2溶液;③加过量的NaOH溶液;④加过量的Na2CO3溶液;⑤ ;⑥加适量的盐酸;⑦ 。
(2)溶液Ⅱ中发生反应的化学方程式是: 。
(3)Mg(OH)2沉淀中因混有Ca(OH)2,可选用___ ___ 溶液进行洗涤以除之。
(4)高温灼烧六水合氯化镁晶体(MgCl2·6H2O)所得固体是氧化镁,试写出该反应的化学方程式________ __ 。
(5)若在母液中通入氯气可提取海水中的溴,反应的离子方程式为:_____ _______。
海水资源的利用将走综合开发的道路,一次提取海水,同时提取多种物质。下图是某工厂对海水资源综合利用的示意图。

试回答下列问题:
(1)提纯粗盐后的母液中含有K+、Mg2+、Na+等阳离子,对母液进行一系列的加工可以制得金属镁。
①从充分利用当地海洋化学资源,提高生产与经济效益的角度考虑,生产石灰乳的化学方程式是__________________________________________。
②从离子反应的角度思考,在母液中加入石灰乳的目的是____________________________;
③在生产中,常涉及反应MgCl2·6H2O![]() MgCl2+6H2O,该反应需要在HCl气氛中才能顺利完成,其理由是_______________________。
MgCl2+6H2O,该反应需要在HCl气氛中才能顺利完成,其理由是_______________________。
(2)在提取Mg(OH)2后和剩余母液中加入一种常见的气态氧化剂,又可制取重要的化工原料溴单质。
①生产中将溴单质从混合物中分离出来的方法是_________________。
②以下是对生产溴单质所用的气态氧化剂寻找提供货源的设想,其中合理的是___________。
A.从外地购买
B.从本厂生产烧碱处循环
C.从本厂生产镁单质处循环
D.在当地新建生产工厂
③从多种经营综合开发,打造大而强的现代化企业及本厂生产所需要的原料等方面来看,你认为该厂还可以再增加的生产项目是_________________。
(14分)工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺线路如下:
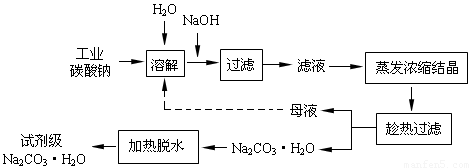
Ⅰ、碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:
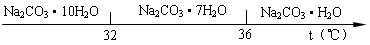
Ⅱ、25℃时有关物质的溶度积如下:
|
物质 |
CaCO3 |
MgCO3 |
Ca(OH)2 |
Mg(OH)2 |
Fe (OH)3 |
|
Ksp |
4.96×10-9 |
6.82×10-6 |
4.68×10-6 |
5.61×10-12 |
2.64×10-39 |
回答下列问题:
(1)加入NaOH溶液时发生的离子方程式为:
▲ 。
25℃时,向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的
pH=8时,c(Mg2+):c(Fe3+)= ▲ 。
(2)“趁热过滤”时的温度应控制在 ▲ 。
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线所示进行循环使用。
请你分析实际工业生产中是否可行 ▲ ,并说明理由:
▲ 。
(4)已知:Na2CO3·10 H2O(s)=Na2CO3(s)+10 H2O(g) △H=+ 532.36kJ·mol-1
Na2CO3·10 H2O (s)=Na2CO3·H2O(s)+9 H2O(g) △H=+ 473.63kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式 ▲ 。
(14分)镁、铝是两种重要的金属,它们的单质及化合物有着各自的性质。
Ⅰ.海水中含有氯化镁,是镁的重要来源之一。从海水中制取镁,某同学设计了如下
流程步骤:
主要的步骤总结如下:①把贝壳制成石灰乳 ②往母液中加石灰乳,沉降、过滤,得到Mg(OH)2沉淀 ③将沉淀物与盐酸反应,结晶、过滤,将制得的晶体脱水得无水MgCl2
④将得到的产物熔融后电解。
(1)下列说法不正确的是__________________(填代号)
| A.此法的优点之一是原料来源丰富 |
| B.进行①②③步骤的目的是从海水中提取氯化镁 |
| C.第④步电解法制取镁是由于镁是很活泼的金属 |
| D.以上制取镁的过程中涉及的反应有分解反应、化合反应和置换反应 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com