
题目列表(包括答案和解析)
| 项目 | pH | Ca2+、Mg2+总浓度/mol?L-1 | 细菌个数/mL-1 |
| 相关值 | 6.5~8.5 | <0.0045 | <100 |

| A、0.0045 mol/(L?s) | B、0.00075 mol/(L?s) | C、0.0010 mol/(L?s) | D、0.0015mol/(L?s) |
下列反应属于吸热反应的是
A. C6H12O6(葡萄糖aq)+6O2 =6CO2+6H2O
B. CH3COOH+KOH = CH3COOK+H2O
C. A+B= C+D; △H<0
D.反应物的总键能大于生成物的总键能
可逆反应mA(g)? ?nB(g)+pC(s) ΔH=Q,温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图象,以下叙述正确的是( )
?nB(g)+pC(s) ΔH=Q,温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图象,以下叙述正确的是( )

A.m>n,Q>0 B.m>n+p,Q>0
C.m>n,Q<0 D.m<n+p,Q<0
合成氨反应工艺成为人工固氮的最重要途径。N2(g)+3H2(g)
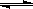 2 NH3 (g) ΔH<0,达平衡后,将气体混合物的温度降低,下列叙述中正确的是
2 NH3 (g) ΔH<0,达平衡后,将气体混合物的温度降低,下列叙述中正确的是
A. 正反应速率增大,逆反应速率减小,平衡一定向正反应方向移动
B. 正反应速率减小,逆反应速率减小,平衡一定向逆反应方向移动
C. 若同时扩大容器的体积,则正逆反应速率一定都减小,平衡向逆反应方向移动
D. 若温度降低至氨气液化,则平衡一定向正反应方向移动,氨气产率提高
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com