
题目列表(包括答案和解析)
镍、钴、铈、铬虽然不是中学阶段常见的金属元素,但在工业生产中有着重要的作用。
(1)二氧化铈 (CeO2)是一种重要的稀土氧化物,在平板电视显示屏中有着重要的应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,H2O2在该反应中作_____(填“氧化”“还原”)剂,每有1mol H2O2参加反应,转移电子的物质的量为_____。
(2)某锂离子电池含Li+导电固体为电解质。充电时,Li+还原为Li,并以原子形式嵌入电极材料碳(C6)中,以LiC6表示,电池反应为LiCoO2+ C6 CoO2+LiC6。则放电时,电池的正极反应式为________________,如图表示该装置工作时电子和离子的移动方向,此时该电池处于_________(填“放电”或“充电”)状态。
CoO2+LiC6。则放电时,电池的正极反应式为________________,如图表示该装置工作时电子和离子的移动方向,此时该电池处于_________(填“放电”或“充电”)状态。
(3)自然界Cr主要以三价Cr和六价Cr的形式存在。六价Cr能引起细胞的突变和癌变。可以用亚硫酸钠将其还原为三价铬,完成并配平下列离子方程式:__Cr2O72-+__SO32-+__H+=__Cr3++__SO42-+ __ ____
(4)NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Zn、Fe等元素)为原料获得。操作步骤如下:
向滤液Ⅰ中加入FeS主要目的是除去Cu、Zn等杂质,除去Cu2+的离子方程式为______________________。
②向滤液Ⅱ中加入H2O2,溶液中发生反应的离子方程式为__________________,调节pH的目的是______________________。
③滤液Ⅲ溶质的主要成分是NiSO4,再加入碳酸钠过滤后,加稀硫酸溶解又生成NiSO4的目的是______________________。
④我国第五套人民币中的一元硬币材料为钢芯镀镍,镀镍时,镍应作_____极。
 CoO2+LiC6。则放电时,电池的正极反应式为________________,如图表示该装置工作时电子和离子的移动方向,此时该电池处于_________(填“放电”或“充电”)状态。
CoO2+LiC6。则放电时,电池的正极反应式为________________,如图表示该装置工作时电子和离子的移动方向,此时该电池处于_________(填“放电”或“充电”)状态。

(12分) A-E六种元素中,除A外均为短周期元素,它们的原子结构或性质如表所示:
| 序号 | 元素 | 结构或性质 |
| ① | A | 生活中常见的金属,它有两种氯化物,相对分子质量相差35.5 |
| ② | B | 原子最外层电子数是内层电子数的1/5 |
| ③ | C | K层和M层上电子数之和等于L层上电子数 |
| ④ | D | 与B同周期,且最外层电子数等于电子层数 |
| ⑤ | E | 1—20号元素中原子半径最大(除稀有气体外) |
(1)工业上利用D单质与A的一种红色氧化物反应,在野外焊接钢轨,其化学方程式: 。
(2)分别由A、B、D、E所形成的简单离子中,具有还原性的离子是 ,氧化性最弱的离子是 。(填离子符号)
(3)D的最高价氧化物对应水化物常用于治疗胃酸(含盐酸)过多症,请写出有关反应的化学方程式 。
(4)证明物质中含有E元素的方法是: 用洁净的铂丝棒蘸取少量含E元素的物质在酒精灯上灼烧,能够观察到 色火焰。
(5)B与D形成的合金是工业上重要的材料。写出该合金在工业上的一个用途 。某同学仅使用天平和右图所示的装置测定某些数据即可求出该合金中B元素的含量。
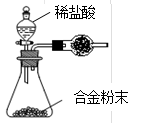
①实验需要测定三个物理量:合金的质量m、a和b。
a是反应前装置和药品的总质量;
b是 ;
②干燥管中盛放的试剂最好是 。
③合金中B元素的质量分数是 (用m、a、b表示)。
(12分) A-E六种元素中,除A外均为短周期元素,它们的原子结构或性质如表所示:
|
序号 |
元素 |
结构或性质 |
|
① |
A |
生活中常见的金属,它有两种氯化物,相对分子质量相差35.5 |
|
② |
B |
原子最外层电子数是内层电子数的1/5 |
|
③ |
C |
K层和M层上电子数之和等于L层上电子数 |
|
④ |
D |
与B同周期,且最外层电子数等于电子层数 |
|
⑤ |
E |
1—20号元素中原子半径最大(除稀有气体外) |
(1)工业上利用D单质与A的一种红色氧化物反应,在野外焊接钢轨,其化学方程式: 。
(2)分别由A、B、D、E所形成的简单离子中,具有还原性的离子是 ,氧化性最弱的离子是 。(填离子符号)
(3)D的最高价氧化物对应水化物常用于治疗胃酸(含盐酸)过多症,请写出有关反应的化学方程式 。
(4)证明物质中含有E元素的方法是: 用洁净的铂丝棒蘸取少量含E元素的物质在酒精灯上灼烧,能够观察到 色火焰。
(5)B与D形成的合金是工业上重要的材料。写出该合金在工业上的一个用途 。某同学仅使用天平和右图所示的装置测定某些数据即可求出该合金中B元素的含量。
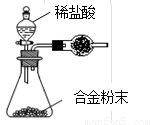
①实验需要测定三个物理量:合金的质量m、a和b。
a是反应前装置和药品的总质量;
b是 ;
②干燥管中盛放的试剂最好是 。
③合金中B元素的质量分数是 (用m、a、b表示)。
(16分)I、关于As的反应中,反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
①已知KBrO3在反应中得到电子,则该反应的还原剂是 。
②已知0.2molKBrO3在反应中得到1mol电子生成X,则X的化学式为 。
③根据上述反应可推知 。(填序号)
A.氧化性:KBrO3>H3AsO4 B.氧化性:H3AsO4>KBrO3
C.还原性:AsH3>X D.还原性:X>AsH3
④在该反应中,氧化剂与还原剂的物质的量之比为 。
Ⅱ、X、Y、Z、W、L、M六种短周期主族元素的原子序数依次增大,其中X、M的单质在常温下呈气态,Y的原子最外层电子数是其电子层数的2倍,Z在同周期的主族元素中原子半径最大,W是地壳中含量最多的金属元素,L的单质晶体熔点高、硬度大,是一种重要的半导体材料。用化学用语回答下列问题:
(1)M在元素周期表中的位置为 。
(2)Y、L、M的最高价含氧酸的酸性由弱到强的顺序是 (写化学式)。
(3)原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是 。
(4)写出Z的最高价氧化物对应的水化物与单质W反应的离子方程式为
。
(5)R与Y同周期,R的单质分子R2中有3个共价键,R与L能形成一种新型无机非金属材料,其化学式是 。
(6)碘是人体必需的微量元素之一,有“智力元素”之称。我国从1989年开始,逐步以KIO3取代KI加工碘盐。已知在酸性溶液中可发生反应:![]() +5I-+6H+=3I2+3H2O,据此反应,可用试纸和一些生活中常见的物质设计实验,证明食盐中存在
+5I-+6H+=3I2+3H2O,据此反应,可用试纸和一些生活中常见的物质设计实验,证明食盐中存在 。可供选用的物质有:①自来水;②蓝色石蕊试纸;③碘化钾淀粉试纸;④淀粉;⑤食醋;⑥白酒;⑦食糖。你认为进行上述实验时必须使用的物质是 (填序号)。
。可供选用的物质有:①自来水;②蓝色石蕊试纸;③碘化钾淀粉试纸;④淀粉;⑤食醋;⑥白酒;⑦食糖。你认为进行上述实验时必须使用的物质是 (填序号)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com