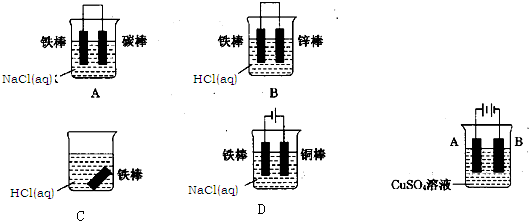
(2011?四川模拟)石油脱硫废气中含有硫化氢,为了有效防止污染,实现废物的综合利用,工业上采用下列工艺过程将硫化氢转化为硫酸和氢气等产品.
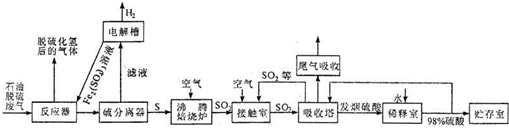
请回答下列问题:
(1)反应器中装有硫酸铁的酸性溶液,该溶液与硫化氢反应的离子方程式是
2Fe3++H2S=2Fe2++2H++S↓
2Fe3++H2S=2Fe2++2H++S↓
.
(2)滤液电解后,得到硫酸铁的酸性溶液,再将其返回到反应器中的目的是
使硫酸铁的酸性溶液循环使用
使硫酸铁的酸性溶液循环使用
.
(3)在实际生产中,二氧化硫转化为三氧化硫的适宜条件是:V
2O
5作催化剂、常压、400℃~500℃.如图是不同压强下该反应体系中温度与二氧化硫的平衡转化率变化曲线.
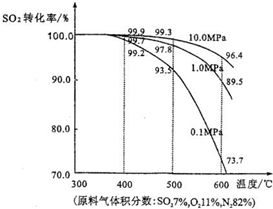
考虑工业生产效益并结合图示分析,选择400℃~500℃的原因是
在此温度下,反应速率和平衡转化率都较高
在此温度下,反应速率和平衡转化率都较高
;
选择常压的原因是
常压下,平衡转化率较高,且不会因加压造成设备造价和耗能增加
常压下,平衡转化率较高,且不会因加压造成设备造价和耗能增加
.
(4)工业上常用过量氨水吸收尾气中的二氧化硫,该反应的化学方程式是
SO2+2NH3?H2O=(NH4)2SO3+H2O
SO2+2NH3?H2O=(NH4)2SO3+H2O
.
(5)生产过程中,接触室生成的三氧化硫用98%的硫酸吸收,制得一种发烟硫酸(9H
2SO
4?SO
3).某硫酸车间10小时消耗的硫为at,则平均每小时从吸收塔流出的该发烟硫酸为
t(在生产过程中硫的损失忽略不计).