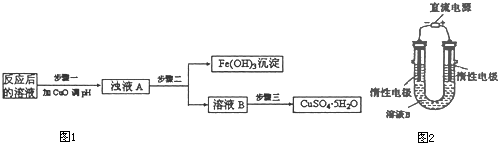
(1)纳米级Cu
2O由于具有优良的催化性能而受到关注.已知:
2Cu(s)+
O
2(g)═Cu
2O(s)△H=-169kJ?mol
-1,
C(s)+
O
2(g)═CO(g)△H=-110.5kJ?mol
-1,
2Cu(s)+O
2(g)═CuO(s)△H=-314kJ?mol
-1则工业上用炭粉在高温条件下还原CuO制取Cu
2O和CO的热化学方程式为
C(s)+2CuO(s)=CuO(s)+CO(g)△H=+34.5kJ?mol-1
C(s)+2CuO(s)=CuO(s)+CO(g)△H=+34.5kJ?mol-1
.
(2)某兴趣小组的同学用如图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转.
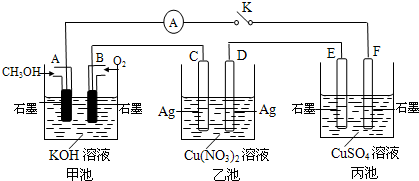
请回答下列问题:
(1)甲池为
原电池
原电池
(填“原电池”、“电解池”或“电镀池”),A电极的电极反应式为
CH3OH+8OH--6e-=CO32-+6H2O
CH3OH+8OH--6e-=CO32-+6H2O
.
(2)丙池中F电极为
阴极
阴极
(填“正极”、“负极”、“阴极”或“阳极”),该池的总反应方程式为
2CuSO
4+2H
2O
2H
2SO
4+2Cu+O
2↑
2CuSO
4+2H
2O
2H
2SO
4+2Cu+O
2↑
.
(3)当池中C极质量减轻10.8g时,甲池中B电极理论上消耗O
2的体积为
560
560
mL(标准状况).
(4)一段时间后,断开电键K,下列物质能使乙池恢复到反应前浓度的是
A
A
(填选项字母).
A.Cu B.CuO C.Cu(OH)
2 D.Cu
2(OH)
2CO
3.

 运用化学反应原理研究元素及其化合物的反应对生产、生活有重要意义.
运用化学反应原理研究元素及其化合物的反应对生产、生活有重要意义.