
题目列表(包括答案和解析)
某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象发如下表:
实验方案 | 实验现象 |
1.用砂纸擦后的镁带与沸水反应,再向反应液中滴加酚酞 2.向新制的H2S饱和溶液中滴加新制的氯水 3.钠与滴有酚酞试液的冷水反应 4.镁带与2mol/L的盐酸反应 5.铝条与2mol/L的盐酸反应 6.向AlCl3溶液中滴加NaOH溶液至过量 | A.浮于水面,熔成小球,四处游动,逐渐缩小,溶液变红色 B.产生大量气体,气体可燃,溶液变浅红色 C.反应不十分强烈,产生的气体可燃 D.剧烈反应,产生的气体可燃 E.生成白色絮状沉淀,继而沉淀消失 F.生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告
(1)实验目的:
(2)实验用品:仪器、材料 略 药品 略
(3)实验内容:(填写题给信息表中的序号或大写英文字母,并写出有空格处的离子
方程式)
实验方案 | 实验现象 | 有关离子方程式 |
| A |
|
| B | 不 填 |
|
| 不 填 |
|
| 不 填 |
| E |
|
| F |
|
(4)实验结论: 。
(5)问题与讨论:
① 请从原子结构理论上简单说明具有上述结论的原因 。
② 请你补充一组实验方案(简单易行),证明此周期中另两种主族元素的性质递变规律。
实验方案 | 实验现象 |
①用砂纸打磨后的镁带与沸水反应,再向反应液中滴加酚酞试液 | A.浮于水面,溶成小球,在水面上无定向移动,随之消失,溶液变成红色 |
②向新制的饱和Na2S溶液中滴加新制的氯水 | B.有气体产生,溶液变成浅红色 |
③钠与滴有酚酞试液的冷水反应 | C.反应不十分剧烈,有气体产生 |
④镁带与稀盐酸反应 | D.剧烈反应,有气体产生 |
⑤铝条与稀盐酸反应 | E.生成白色胶状沉淀,继而沉淀消失 |
⑥向氯化铝溶液中滴加氢氧化钠溶液至过量 | F.生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告
(1)实验目的:______________________________________________________。
(2)实验用品:仪器:①____________ ②____________ ③____________
④试管夹 ⑤镊子 ⑥小刀 ⑦玻璃片 ⑧砂纸 ⑨火柴
药品:钠、镁带、铝条、稀盐酸、新制氯水、饱和Na2S溶液、AICl3溶液、氢氧钠溶液、酚酞试液。
(3)实验内容:(填写与实验方案相对应的实验现象和有关化学反应的离子方程式
实验方案 | 实验现象(填写字母) | 离子方程式 |
① |
|
|
② |
|
|
③ |
|
|
④ |
|
|
⑤ |
|
|
⑥ |
|
|
(4)实验结论:___________________________________________________________。
请从原子结构理论方面简单说明具有上述结论的原因_________________________。
(5)请你补充一个实验方案(简单易行),证明此周期中另两种主族元素的性质递变规律。
_____________________________________________________________________。
[化学—物质结构与性质]
(1)依据第2周期元素第一电离能的变化规律,参照下图B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置。

(2)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2 NF3+3NH4F
NF3+3NH4F
①上述化学方程式中的5种物质所属的晶体类型有_________(填序号)。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
②基态铜原子的核外电子排布式为________。
(3)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:

①晶体Q中各种微粒间的作用力不涉及___________(填序号)。
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.范德华力
②R中阳离子的空间构型为_______,阴离子的中心原子轨道采用_______杂化。
(4)已知苯酚( )具有弱酸性,其Ka=1.1 ×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1 ×10-10;水杨酸第一级电离形成的离子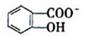 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是__________。
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是__________。

 NF3+3NH4F
NF3+3NH4F
 )具有弱酸性,其Ka=1.1 ×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1 ×10-10;水杨酸第一级电离形成的离子 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是__________。
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是__________。元素周期表反映了元素性质的周期性变化规律。请根据短周期元素在周期表中的位置、结构和相关性质,回答下列问题:
⑴ 短周期元素中,原子最外层电子数和电子层数相等的元素有 种。
⑵ 第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如下表1所示,其中C的化学式为 ;第三周期元素单质的熔点(℃)变化如下图I所示,其中h的元素符号为 。
 ⑶ 原子半径最小的元素与第二周期的两种元素可分别形成分子甲和离子乙。分子甲和离子乙含有相等的电子数,且乙的立体结构如图II所示。请写出甲、乙反应的离子方程式 。
⑶ 原子半径最小的元素与第二周期的两种元素可分别形成分子甲和离子乙。分子甲和离子乙含有相等的电子数,且乙的立体结构如图II所示。请写出甲、乙反应的离子方程式 。
⑷ 第二、第三周期的某些元素中能形成具有图II所示的结构单元的单质丙和化合物丁,丙和丁的晶体类型相同,且丙与丁在高温时能发生置换反应。若该反应中丙被破坏了1 mol共价键,则参加反应的丁的质量为 g。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com