
题目列表(包括答案和解析)
铁是地球表面最丰富的金属之一,能形成多种配合物,铁系催化剂是工业生产中常用的催化剂。
(1)合成氨工业使用的催化剂是以铁为主体的多成分催化剂。
①NH3中N原子的杂化轨道类型是 。
②N与O同属第二周期,N的第一电离能比O大的原因是 。
③根据等电子体原理,写出一种NH4+是等电子体的微粒的化学式____________。
(2)二茂铁[(C5H5)2Fe]是一种金属有机配合物,是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等。它的结构如右所示,其中氢原子的化学环境完全相同。
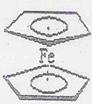
①Fe的基态电子排布式为____________。
②二茂铁中Fe2+与环戊二烯离子(C5H5-)之间的化学键类型是 _______________。
③1mol环戊二烯(![]() )中含有σ键的数目为_________个。
)中含有σ键的数目为_________个。
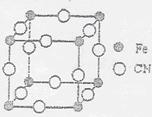
(3)普鲁士蓝俗称铁蓝,结构如图所示,K+未画出),每隔一个立方体在立方体中心含有一个K+离子,普鲁士蓝中铁元素的化合价有+2和+3两种,其中Fe3+与Fe2+的个数比为:_____________。
| |||||||||||||||||||||||
铁元素及其化合物与人类的生产生活息息相关,回答下列问题
(1)铁酸钠(Na2FeO4)是一种新型水处理剂,它有比高锰酸钾更强的氧化性,在水中反应被还原为Fe3+.
①铁酸钠中铁元素的化合价为________.
②铁酸钠用于水处理,除了能消毒杀菌外,还可以像明矾(KAl(SO4)2)一样起到净水作用,请说明明矾的净水原理:________.(用离子方程式表示)
(2)反应ⅠFe(s)+CO2(g) FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;
FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;
反应ⅡCO(g)+1/2O2(g)=CO2(g) ΔH=b kJ·mol-1
测得在不同温度下,K值如下:
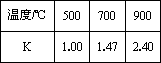
①写出K的表达式________.
②反应Ⅰ中的a________0(填大于、小于、等于).
③若500℃时进行反应Ⅰ,CO2起始浓度为2 0mol·L-1,CO的平衡浓度为________mol·L-1.
④700℃反应Ⅰ达到平衡,要使得该平衡向右移动,其它条件不变时,可以采取的措施有________(填序号).
A.缩小反应器体积
B.通入CO2
C.升高温度到900℃
D.使用合适的催化剂
⑤由反应Ⅰ和Ⅱ可求得,反应2Fe(s)+O2(g)=2FeO(s)的ΔH=________kJ·mol-1.
(3)铁红是一种红色颜料,其成份是Fe2O3.将一定量的铁红溶于160 mL 5 mol·L-1盐酸中,再加入一定量铁粉恰好完全溶解,收集到气体2.24 L(标准状况),经检测,溶液中无Fe3+,则参加反应的铁粉的质量为________g.
六价铬[Cr(Ⅵ)]有剧毒,废水中的Cr2O常用铁氧磁体法除去,即把过量的FeSO4•7H2O加入含Cr2O
的废水中,调节pH<4,Fe2+还原Cr(Ⅵ)为Cr3+。
(1)写出Fe2+还原Cr2O的离子方程式,并标明电子转移的方向和数目:
_________________________________________________________。
(2)调节(1)得到溶液的pH值为8~10,将析出相当于Fe(Ⅱ)[Fe(Ⅲ)xCr2-x]O4(磁性材料铁氧体)的沉淀,由(1)可确定x=_______。
(3)Cr3+在过量的NaOH溶液中会转化为CrO,写出这一转化的离子方程式_______________________________,由此可知Cr(OH)3呈_________(选填“酸”、“碱”或“两”)性。
六价铬[Cr(Ⅵ)]有剧毒,废水中的Cr2O 常用铁氧磁体法除去,即把过量的FeSO4?7H2O加入含Cr2O
常用铁氧磁体法除去,即把过量的FeSO4?7H2O加入含Cr2O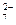 的废水中,调节pH<4,Fe2+还原Cr(Ⅵ)为Cr3+。
的废水中,调节pH<4,Fe2+还原Cr(Ⅵ)为Cr3+。
(1)写出Fe2+还原Cr2O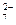 的离子方程式,并标明电子转移的方向和数目:
的离子方程式,并标明电子转移的方向和数目:
_________________________________________________________。
(2)调节(1)得到溶液的pH值为8~10,将析出相当于Fe(Ⅱ)[Fe(Ⅲ)xCr2-x]O4(磁性材料铁氧体)的沉淀,由(1)可确定x=_______。
(3)Cr3+在过量的NaOH溶液中会转化为CrO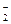 ,写出这一转化的离子方程式_______________________________,由此可知Cr(
,写出这一转化的离子方程式_______________________________,由此可知Cr( OH)3呈_________(选填“酸”、“碱”或“两”)性。
OH)3呈_________(选填“酸”、“碱”或“两”)性。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com