
题目列表(包括答案和解析)
取2mL浓度为2×10-4mol/L的NaNO3溶液于试管,加入约4mL浓度为2mol/L的NaOH溶液,再加入适量铝粉,加热,用湿润的红色石蕊试纸检验产生的气体。实验中观察到试管中立即产生大量气泡,一段时间后试纸变蓝,铝粉溶解,溶液澄清不变色。请据以上实验事实分析:
(1)使湿润的红色石蕊试纸变蓝的气体是______________;
(2)写出NO3-发生反应的离子方程式,配平并填空。
Al + NO3-+ _______ + H2O → AlO2-+ _______ 氧化产物是____________
(3)为检验某含氮废水中是否含有NO3-,以废水水样2mL代替NaNO3溶液进行上述实验,现象相同,有同学认为无法据此得出“一定有NO3-”的结论,理由是废水中可能存在的_________________ (填离子符号)对实验结果有干扰;
(4)工业上利用铝粉除去含氮废水中的NO3-,当控制溶液pH在10.7左右时,所得产物中还有氮气。若氮气和氨气的体积比为4:1,则除去0.1mol NO3-,消耗铝______ g。
(10分)取2mL浓度为2×10-4mol/L的NaNO3溶液于试管,加入约4mL浓度为2mol/L的NaOH溶液,再加入适量铝粉,加热,用湿润的红色石蕊试纸检验产生的气体。实验中观察到试管中立即产生大量气泡,一段时间后试纸变蓝,铝粉溶解,溶液澄清不变色。请据以上实验事实分析:
(1)使湿润的红色石蕊试纸变蓝的气体是______________;
(2)写出NO3-发生反应的离子方程式,配平并填空。
Al + NO3-+ _______ + H2O → AlO2-+ _______ 氧化产物是____________
(3)为检验某含氮废水中是否含有NO3-,以废水水样2mL代替NaNO3溶液进行上述实验,现象相同,有同学认为无法据此得出“一定有NO3-”的结论,理由是废水中可能存在的_________________ (填离子符号)对实验结果有干扰;
(4)工业上利用铝粉除去含氮废水中的NO3-,当控制溶液pH在10.7左右时,所得产物中还有氮气。若氮气和氨气的体积比为4:1,则除去0.1mol NO3-,消耗铝______ g。
强酸与强碱的稀溶液发生中和反应的热效应为H+(aq)+OH-(aq)==H2O(l) ΔH=-57.3 kJ·mol-1。实验中因为下列措施使求得的中和热数值变大的是
A. 烧杯间填满金属碎末
B. 大烧杯上不盖硬纸板
C. 用相同浓度和体积的氨水代替NaOH溶液进行实验
D.用浓硫酸代替稀盐酸
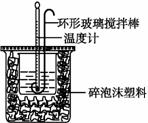
Ⅰ.(4分)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品 是 。
(2)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
(3)如果反应前后的温度差是(t2-t1),盐酸、氢氧化钠溶液的密度均为1g/cm3,比热容为4.18J/(g•℃),写出该实验中和热的计算式:△H=
Ⅱ.(12分)影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol/L、2 mol/L、18.4 mol/L)。设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如下表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2 mol/L的硫酸于试管中 | 反应速率Mg>Fe,Cu不反应 | 金属的性质越活泼,反应速率越快 |
| ②___________________ |
(1)甲同学表中实验步骤②为____________________________________________。
(2)甲同学的实验目的是______________________________________;要得出正确的实验结论,还需控制的实验条件是________。
乙同学为了更精确的研究浓度对反应速率的影响,利用下图所示装置进行定量实验。
(3)乙同学在实验中应该测定的数据是______________。
(4)乙同学完成该实验应选用的实验药品是___________。
该实验中不选用某浓度的硫酸,理由是____________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com