
题目列表(包括答案和解析)
|
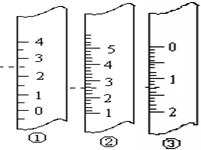
下列操作一定会使实验结果偏高的是:________ | |
A. |
用标准HCl溶液滴定未知浓度的NaOH溶液,碱式滴定管未经润洗就直接取 20mLNaOH溶液 |
B. |
用冷却结晶法测定不同温度下的KNO3的溶解度,没有在析出晶体时立即读温度计的读数 |
C. |
用加热法测定CuSO4晶体中结晶水的含量,坩埚不干燥,且加热不充分 |
D. |
配制一定物质的量浓度NaOH溶液,定容时仰视容量瓶液面E、在中和热的测定实验中,准确量取0.5mol/L的NaOH溶液100ml和10mol/L的H2SO4溶液5ml在保温性好的量热器中进行. |

 CH3COOH+OH-
CH3COOH+OH- CH3COOH+OH-
CH3COOH+OH-1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
D
D
B
C
C
B
D
A
C
D
D
C
C
A
AD
B
17、3.2 ,D
18、(1)不会,当酚酞变色时的PH值条件下,HCl是与NaOh发生反应,不会与BaCO3作用。
(2)浅红色 无色
(3)不能。因滴定管下方刻度线距活塞处有一定空间,不能测出其所用的滴定液体积
(4)不能 偏高
19、(1)BDCEAF
(2)防止将标准液稀释
(3)偏大
(4)滴定管活塞;锥形瓶中溶液的颜色变化;锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色。
(5)偏小 (6)偏大
20、NaOH+HCl====NaCl+H2O
Na2CO3+HCl====NaHCO3+NaCl
NaOH+HCl====NaCl+H2O
Na2CO3+2HCl====2NaCl+CO2↑+H2O;

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com