
题目列表(包括答案和解析)
 下图所示(反应条件均已略去).
下图所示(反应条件均已略去).
| ||
| △ |
| ||
| △ |
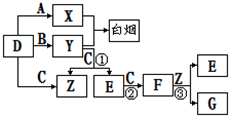
A、B、C、D是短周期元素形成的四种气体单质。E、F均为气体,且F为
红棕色。有关的转化关系如下图所示(反应条件均已略去)。
请回答下列问题:
(1)D的化学式为 ;
(2)反应③的离子方程式为 。
(3)Y和E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为 。
(4)0.1mol/L的X溶液和0.1mol/L的Y溶液等体积混合,溶液呈________性;(填“酸”、“碱”或“中”)原因是: __________________________________
(用离子方程式说明)
(5)常温下0.1mol/L的Y溶液中c(H+)/c(OH-)=1×10-8,下列叙述正确的是( )
A.该溶液的pH=11;
B.该溶液中的溶质电离出的阳离子浓度0.1mol/L
C.该溶液中水电离出的c(H+)与c(OH-)乘积为1×10-22
D.pH=3的盐酸溶液V1 L与该0.1mol/L的Y溶液V2 L混合,若混合溶液pH=7,则:V1>V2
E.将以上溶液加水稀释100倍后,pH值为9;
A、B、C、D是短周期元素形成的四种气体单质。E、F均为气体,且F为
红棕色。有关的转化关系如下图所示(反应条件均已略去)。
请回答下列问题:
(1)D的化学式为 ;
(2)反应③的离子方程式为 。
(3)Y和E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为 。
(4)0.1mol/L的X溶液和0.1mol/L的Y溶液等体积混合,溶液呈________性;(填“酸”、“碱”或“中”)原因是: __________________________________
(用离子方程式说明)
(5)常温下0.1mol/L的Y溶液中c(H+)/c(OH-)=1×10-8,下列叙述正确的是( )
A.该溶液的pH=11;
B.该溶液中的溶质电离出的阳离子浓度0.1mol/L
C.该溶液中水电离出的c(H+)与c(OH-)乘积为1×10-22
D.pH=3的盐酸溶液V1 L与该0.1mol/L的Y溶液V2 L混合,若混合溶液pH=7,则:V1>V2
E.将以上溶液加水稀释100倍后,pH值为9;
 下图所示(反应条件均已略去).
下图所示(反应条件均已略去).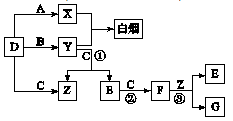
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
D
D
B
C
C
B
D
A
C
D
D
C
C
A
AD
B
17、3.2 ,D
18、(1)不会,当酚酞变色时的PH值条件下,HCl是与NaOh发生反应,不会与BaCO3作用。
(2)浅红色 无色
(3)不能。因滴定管下方刻度线距活塞处有一定空间,不能测出其所用的滴定液体积
(4)不能 偏高
19、(1)BDCEAF
(2)防止将标准液稀释
(3)偏大
(4)滴定管活塞;锥形瓶中溶液的颜色变化;锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色。
(5)偏小 (6)偏大
20、NaOH+HCl====NaCl+H2O
Na2CO3+HCl====NaHCO3+NaCl
NaOH+HCl====NaCl+H2O
Na2CO3+2HCl====2NaCl+CO2↑+H2O;

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com