
题目列表(包括答案和解析)
(12分)某混合溶液中可能含有的离子如下表所示:
|
可能大量含有的阳离子 |
H+、Ag+、Mg2+、Al3+、NH |
|
可能大量含有的阴离子 |
Cl-、Br-、I-、CO |
为探究其成分,进行了以下探究实验。
⑴探究一:
甲同学取一定量的混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如右图所示。

①该溶液中一定不存在的阳离子是______________ ,一定不存在的阴离子是__________;
含有的阳离子其对应物质的量浓度之比为__________________________________,
②请写出沉淀减少过程中发生反应的离子方程式_____________________________。
⑵探究二:
乙同学检测到该溶液中含有大量的Cl-、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
|
Cl2的体积(标准状况) |
11.2 L |
22.4 L |
28.0 L |
|
n (Cl-) |
2.5 mol |
3.5 mol |
4.0 mol |
|
n (Br-) |
3.0 mol |
2.5mol |
2.0 mol |
|
n (I-) |
x mol |
0 |
0 |
①当起始至通入Cl2的体积为22.4L时,溶液中发生反应总的离子方程式为 __________________________________________ ;
②原溶液中Cl-、Br-、I-的物质的量浓度之比为______________________。
工业上以黄铜矿(主要成分是CuFeS2,杂质不溶于水和酸)为原料,制备蓝色晶体G,其化学式为[Cu(NH3)4]SO4·H2O,涉及流程如下:
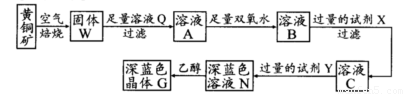
已知25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表:
|
|
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
|
Ksp |
8.0×10-16 |
2.2×10-22 |
4.0×10-38 |
|
完全沉淀pH |
≥9.6 |
≥6.4 |
≥3.2 |
(1)加快黄铜矿焙烧速率,可采用的措施有 (写两种):
(2)加入双氧水可能发生反应的离子方程式为 ;
试剂X的化学式为 。
(3)常温下,0.1 mol/L试剂Y的pH=11,则该温度下,试剂Y的电离常数为 ;
用pH试纸测该溶液pH值的方法是
(4)已知Cu(OH)2+4NH3·H2O [Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式:
。
[Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式:
。
(5)在溶液N中加入乙醇的目的是 。
(12分)某混合溶液中可能含有的离子如下表所示:
|
可能大量含有的阳离子 |
H+、Ag+、Mg2+、Al3+、NH |
|
可能大量含有的阴离子 |
Cl-、Br-、I-、CO |
为探究其成分,进行了以下探究实验。
(1)探究一:
甲同学取一定量的混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如图所示。
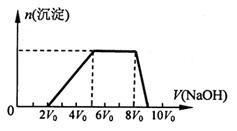
①该溶液中一定含有的阳离子是______________,其对应物质的量浓度之比为________,一定不存在的阴离子是_____________;
②请写出沉淀减少过程中发生反应的离子方程式_____________________________。
(2)探究二:
乙同学检测到该溶液中含有大量的Cl-、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
|
Cl2的体积(标准状况) |
5.6 L |
11.2 L |
22.4 L |
|
n (Cl-) |
2.5 mol |
3.0 mol |
4.0 mol |
|
n (Br-) |
3.0 mol |
2.8 mol |
1.8 mol |
|
n (I-) |
x mol |
0 |
0 |
①当通入Cl2的体积为5.6 L时,溶液中发生反应的离子方程式为_______________;
②原溶液中Cl-、Br-、I-的物质的量浓度之比为______________________。
某混合溶液中可能含有的离子如下表所示:
|
可能大量含有的阳离子 |
H+、Ag+、Mg2+、Al3+、NH |
|
可能大量含有的阴离子 |
Cl-、Br-、I-、CO |
为探究其成分,进行了以下探究实验。
(1)探究一:
甲同学取一定量的混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧 化钠溶液的体积(V)的关系如图所示。

①该溶液中一定含有的阳离子是______________,其对应物质的量浓度之比为________,一定不存在的阴离子是_____________;
②请写出沉淀减少过程中发生反应的离子方程式_____________________________。
(2)探究二:
乙同学检测到该溶液中含有大量的Cl-、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示, 分析后回答下列问题:
|
Cl2的体积(标准状况) |
5.6 L |
11.2 L |
22.4 L |
|
n (Cl-) |
2.5 mol |
3.0 mol |
4.0 mol |
|
n (Br-) |
3.0 mol |
2.8 mol |
1.8 mol |
|
n (I-) |
x mol |
0 |
0 |
①当通入Cl2的体积为5.6 L时,溶液中发生反应的离子方程式为_______________;
②原溶液中Cl-、Br-、I-的物质的量浓度之比为______________________。
某混合溶液中可能含有的离子如下表所示:
| 可能大量含有的阳离子 | H+、Ag+、Mg2+、Al3+、NH |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO |
为探究其成分,进行了以下探究实验。
 (1)探究一:
(1)探究一:
甲同学取一定量的混合溶液,向其中逐滴加入 氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧 化钠溶液的体积(V)的关系如右图所示。
①该溶液中一定含有的阳离子是________
______,其对应物质的量浓度之比为________,一定不存在的阴离子是_____________;
②请写出沉淀减少过程中发生反应的离子方程式_____________________________。
(2)探究二:
乙同学检测到该溶液中含有大量的Cl-、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示, 分析后回答下列问题:
| Cl2的体积(标准状况) | 5.6 L | 11.2 L | 22.4 L |
| n (Cl-) | 2.5 mol | 3.0 mol | 4.0 mol |
| n (Br-) | 3.0 mol | 2.8 mol | 1.8 mol |
| n (I-) | x mol | 0 | 0 |
①当通入Cl2的体积为5.6 L时,溶液中发生反应的离子方程式为_______________;
②原溶液中Cl-、Br-、I-的物质的量浓度之比为______________________。
一、1.解析:Fe Fe2+
Fe2+ Fe3+
Fe3+ Fe(OH)3
Fe(OH)3 Fe2O3。
Fe2O3。
答案:A?
2.B 3.C?
4.解析:根据2Fe3++Fe===3Fe2+知,消耗1 mol Fe生成3 mol Fe2+,还消耗2 mol Fe3+。
答案:C?
5.C 6.A 7.B 8.A 9.C 10.AD?
二、11.Fe2O3 CO和H2 Fe3O4、FeO?
12.(1)白色沉淀 灰绿色
灰绿色 红褐色沉淀?
红褐色沉淀?
(2)3Fe+2NO +8H+===3Fe2++2NO↑+4H2O?
+8H+===3Fe2++2NO↑+4H2O?
(3)由反应2HNO3+NO===3NO2+H2O知,在浓HNO3中不可能生成NO?
13.(1)Fe Cl2 H2?
(2)2Fe+3Cl2 2FeCl3
2FeCl3
(3)2HCl+Fe===FeCl2+H2↑?
(4)2FeCl2+Cl2===2FeCl3?
14.(1)Fe FeCl3 FeCl2 Fe(OH)3 Fe2O3 (2)略?
15.65 g 20.5%?
16.(1)ac?
(2)设Fe2O3原有n0 mol,还原百分率为A%,则有?


A%= ≈33.3%
≈33.3%
(3)3-
(4)Fe2O3、Fe3O4 8<a<9?
Fe3O4、FeO 6<a<8?
Fe2O3、Fe3O4、FeO 6<a<9
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com