
题目列表(包括答案和解析)
某氯碱厂用海水制取NaOH的工艺流程示意图如下:

依据上图,完成下列填空:
(1)从海水中提取粗盐的方法是________,粗盐含Ca2+、Mg2+等杂质,精制过程的离子方程式为________.
(2)如果粗盐中SO![]() 含量较高,必须添加钡试剂除去SO
含量较高,必须添加钡试剂除去SO![]() ,该钡试剂可以是________(填序号).
,该钡试剂可以是________(填序号).
a.Ba(OH)2
b.Ba(NO3)2
c.BaCl2
(3)为有效除去Ca2+、Mg2+、SO![]() ,加入试剂的合理顺序为________(填序号).
,加入试剂的合理顺序为________(填序号).
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(4)在电解过程中,与电源正极相连的电极上所发生反应的化学方程式为________,与电源负极相连的电极附近,溶液pH________(填“不变”、“升高”或“下降”).
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过________、冷却、________(填写操作名称)除去NaCl.
(6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为________.
请回答氯碱工业中的如下问题:
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k= (要求写出计算表达式和结果);
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)、③BaCl2,这3种试剂添加的合理顺序是 (填序号);
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
①图中X、Y分别是 、 (填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小 ;
②分别写出燃料电池B中正极、负极上发生的电极反应,正极: ;负极: ;
③这样设计的主要节(电)能之处在于(写出2处) 、 。
请回答氯碱工业中的如下问题:
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k= (要求写出计算表达式和结果);
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)、③BaCl2,这3种试剂添加的合理顺序是 (填序号);
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
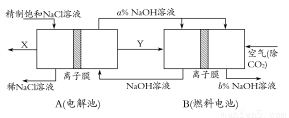
①图中X、Y分别是 、 (填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小 ;
②分别写出燃料电池B中正极、负极上发生的电极反应,正极: ;负极: ;
③这样设计的主要节(电)能之处在于(写出2处) 、 。
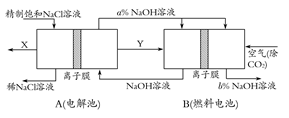
图1是氯碱工业中离子交换膜电解槽示意图,其中离子交换膜是“阳离子交换膜”,它有一特殊的性质——只允许阳离子通过而阻止阴离子和气体通过。
⑴、工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为 ▲ , ▲ 。
⑵、如果粗盐中SO![]() 含量较高,必须添加钡式剂除去SO
含量较高,必须添加钡式剂除去SO![]() ,该钡试剂可以是 ▲ 。
,该钡试剂可以是 ▲ 。
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
⑶、为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为 ▲ 。
A.先加NaOH,后加Na2CO3,再加钡试剂
B.先加NaOH,后加钡试剂,再加Na2CO3
C.先加钡试剂,后加NaOH,再加Na2CO3
⑷、电解后得到的氢氧化钠溶液从 ▲ 口流出,b口排出的是 ▲ 气体,电极1应连接电源的
▲ 极(填“正”或“负”极);理论上讲,从f口加入纯水即可,但实际生产中,纯水中要加入一定量的NaOH溶液,其原因是 ▲ 。
⑸、图2是根据氯碱工业中离子交换膜技术原理,设计的电解Na2SO4溶液生产NaOH和H2SO4溶液的装置。请回答:
①、a为 ▲ (填“阳”、“阴”)离子交换膜。
②、阳极的电极反应式是 ▲ 。
③、从D、E口流出或流进的物质的化学式分别为 ▲ , ▲ 。
一、1.D?
2.解析:Cl2被完全吸收,Cl2应在下部生成,推知b为正极,a为负极。?
答案:B?
3.C 4.CD 5.B 6.A 7.A 8.BD 9.A?
二、10.(1)Fe Fe-2e-===Fe2+ (2)BC?
(3)隔离空气,防止生成的Fe(OH)2被氧化 加热c,以除去溶解的O2?
(4)BC?
(5)白色沉淀迅速变成灰绿色,最后变成红褐色?
11.(1)有红色物质析出为负极 (2)铜导线变粗为负极?
12.(1)2Cl--2e-===Cl2↑ 升高?
(2)Ca2++CO ===CaCO3↓?
===CaCO3↓?
Mg2++2OH-===Mg(OH)2↓?
(3)AC (4)BC (5)蒸发 过滤?
(6)NaCl+H2O NaClO+H2↑(或2NaCl+2H2O
NaClO+H2↑(或2NaCl+2H2O 2NaOH+H2↑+Cl2↑?
2NaOH+H2↑+Cl2↑?
Cl2+2NaOH===NaCl+NaClO+H2O)?
13.(1)B (2)C?
(3)5KI+KIO3+6HCl===6KCl+3I2+3H2O 5∶1 溶液变蓝?
(4)阳极:I-+3H2O-6e-===IO-3+6H+?
阴极:6H2O+6e-===3H2↑+6OH-?
(5)0.837?
14.T介于
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com