
题目列表(包括答案和解析)
| |||||||||||||||
 (1)某燃料电池以熔融K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷(C4H10)为原料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属为电极.
(1)某燃料电池以熔融K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷(C4H10)为原料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属为电极.
| ||
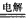 KIO3+3H2↑,则此反应中氧化剂为________________,还原剂为_________________。
KIO3+3H2↑,则此反应中氧化剂为________________,还原剂为_________________。现代生活中,人们越来越重视对微量元素的平衡摄入量。幼儿缺碘元素,会造成痴呆、发育不良;成人缺碘会患地方性甲状腺肿大。为控制该病的发生,有效的方法是食用加碘食盐。我国卫生部规定每千克食盐中应含有20~50 mg的碘元素。
(1)碘是合成________的主要原料之一。
A.胰岛素
B.甲状腺激素
C.生长激素
(2)加碘食盐包装袋上通常印有如下建议:“菜未熟不宜加入碘盐”。请简述其中所包含的化学原理
________________________________________________________________________
________________________________________________________________________。
(3)已知KIO3可用电解方法制得。其原理是:以石墨为阳极,以不锈钢为阴极,在一定电流强度和温度下电解KI溶液。总反应方程式为KI+3H2O KIO3+3H2↑,则此反应中氧化剂为__________,还原剂为__________。
KIO3+3H2↑,则此反应中氧化剂为__________,还原剂为__________。
 KlO3+3H2↑,则阴极反应式为:______.
KlO3+3H2↑,则阴极反应式为:______.一、1.D?
2.解析:Cl2被完全吸收,Cl2应在下部生成,推知b为正极,a为负极。?
答案:B?
3.C 4.CD 5.B 6.A 7.A 8.BD 9.A?
二、10.(1)Fe Fe-2e-===Fe2+ (2)BC?
(3)隔离空气,防止生成的Fe(OH)2被氧化 加热c,以除去溶解的O2?
(4)BC?
(5)白色沉淀迅速变成灰绿色,最后变成红褐色?
11.(1)有红色物质析出为负极 (2)铜导线变粗为负极?
12.(1)2Cl--2e-===Cl2↑ 升高?
(2)Ca2++CO ===CaCO3↓?
===CaCO3↓?
Mg2++2OH-===Mg(OH)2↓?
(3)AC (4)BC (5)蒸发 过滤?
(6)NaCl+H2O NaClO+H2↑(或2NaCl+2H2O
NaClO+H2↑(或2NaCl+2H2O 2NaOH+H2↑+Cl2↑?
2NaOH+H2↑+Cl2↑?
Cl2+2NaOH===NaCl+NaClO+H2O)?
13.(1)B (2)C?
(3)5KI+KIO3+6HCl===6KCl+3I2+3H2O 5∶1 溶液变蓝?
(4)阳极:I-+3H2O-6e-===IO-3+6H+?
阴极:6H2O+6e-===3H2↑+6OH-?
(5)0.837?
14.T介于
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com