
题目列表(包括答案和解析)
| | HF | HCl | HBr | HI |
| 键能/kJ·mol-1 | 568.6 | 431.8 | 365.7 | 298.7 |
| 键长/pm | 92 | 127.6 | 141.0 | 162 |
 氮的氧化物和SO2是常见的化工原料,但也是大气的主要污染物.综合治理其污染是化学家研究的主要内容.根据题意完成下列各题:
氮的氧化物和SO2是常见的化工原料,但也是大气的主要污染物.综合治理其污染是化学家研究的主要内容.根据题意完成下列各题:
| ||
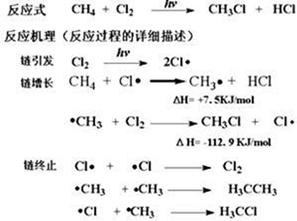
甲烷与氧气按一定比例混合后点燃,生成物总质量18.4 g,通过浓H2SO4后,质量减少9.0 g,则原混合气体中甲烷和氧气的体积比是______________,燃烧反应的化学方程式为______________________________________________________________________________。
(15分)甲烷是天然气、沼气、坑气及煤气的主要成分之一,可用作燃料及制造氢、一氧化碳、甲醛等物质的原料,其中用作制氢合成氨的工艺流程示意图如下: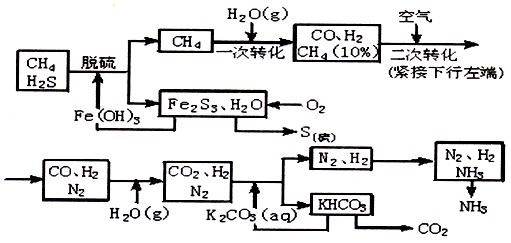
依据上述流程,完成下列填空:
(1)天然气脱硫时的化学方程式是_______________________________。
(2)n mol CH4经一次转化后产生CO 0.9n mol,产生H2_____________mol,假设后面几步转化各物质均完全反应,则理论上可制备得到氨气 mol(用含n的代数式表示)
(3)K2CO3(aq)和CO2反应在加压下进行,加压的理论依据是___________
A.相似相容原理 B.勒夏特列原理 C. 酸碱中和原理
(4)分析流程示意图回答,该合成氨工艺主要起始原料是 ,辅助原料有_________。
(5)整个流程有三处循环,一是Fe(OH)3循环,二是 循环,三是N2、H2循环。
一、1.C 2.D 3.C 4.D 5.B 6.D 7.A 8.A 9.C?
二、10.(1)3,4―二甲基辛烷 10?
(2)环十二烷 18 ?
11.(1)O2、CuO?
(2)CaCl2、P2O5 碱石灰?
(3)w(C)= %?
%?
12.A为CH4,B为C3H8时,两者的体积比为:V(CH4)∶V(C3H8)=1∶3;A为C2H6,B为C4H10时,两者的体积比为V(C2H6)∶V(C4H10)=3∶1
13.(1)g f e h i c d(或d c)a b(或b a);?
(2)吸收水分,干燥O2?
(3)作催化剂,加大产生O2的速率?
(4)使有机物更充分的氧化成CO2和H2O?
(5)CH2O (6)测定有机物的式量?
14.(1)CH4+2O2

1 mol 80 g
原混合气体中n(CH4)= =0.0075 mol?
=0.0075 mol?
则V(CH4)=0.0075 mol×22.4×103 mL?mol-1=168 mL?
故剩余气体840 mL-3×168 mL=336 mL
(2)V(CH4)∶V(O2)=168 mL∶(840 mL-168 mL)?=1∶4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com