
题目列表(包括答案和解析)


| ||
| ||
| 65Y |
| 16X |
| 65Y |
| 16X |
一、1.C 2.D 3.C 4.D 5.B 6.D 7.A 8.A 9.C?
二、10.(1)3,4―二甲基辛烷 10?
(2)环十二烷 18 ?
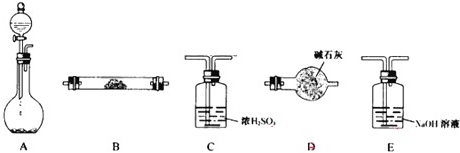
11.(1)O2、CuO?
(2)CaCl2、P2O5 碱石灰?
(3)w(C)= %?
%?
12.A为CH4,B为C3H8时,两者的体积比为:V(CH4)∶V(C3H8)=1∶3;A为C2H6,B为C4H10时,两者的体积比为V(C2H6)∶V(C4H10)=3∶1
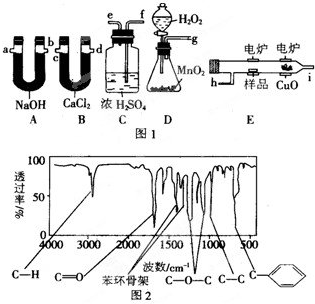
13.(1)g f e h i c d(或d c)a b(或b a);?
(2)吸收水分,干燥O2?
(3)作催化剂,加大产生O2的速率?
(4)使有机物更充分的氧化成CO2和H2O?
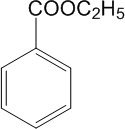
(5)CH2O (6)测定有机物的式量?
14.(1)CH4+2O2

1 mol 80 g
原混合气体中n(CH4)= =0.0075 mol?
=0.0075 mol?
则V(CH4)=0.0075 mol×22.4×103 mL?mol-1=168 mL?
故剩余气体840 mL-3×168 mL=336 mL
(2)V(CH4)∶V(O2)=168 mL∶(840 mL-168 mL)?=1∶4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com