
题目列表(包括答案和解析)
X元素原子的质量数为m,核内中子数为n,则wgx+含有电子的物质的量是( )
A.(m-n)w/mmol B.(m-n-1)w/mmol
C.(m+n)w/mmol D. (m-n+1)w/mmol
(14分)下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
(1)已知该产业链中某反应的平衡表达式为:K=
它所对应的化学反应为:
(2)已知在一定温度下,各反应的平衡常数如下:
C(s)+C02(g)  2C0(g) △H>O,K1
①
2C0(g) △H>O,K1
①
CO(g)+H20(g)  H2(g)+C02(g),K2
②
H2(g)+C02(g),K2
②
C(s)+H20(g)  CO(g)+H2(g),K3 ③
CO(g)+H2(g),K3 ③

则K1、K2、K3,之间的关系是: 。
反应①的平衡常数K随温度的升高而 (增大/减小/不变)。
一定温度下,在三个容积均为2L的容器中均进行着③反应,各物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。

简述理由:
(3)该产业链中氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如N0、N02、N204等。对反应N2O4(g)
 2N02(g) △H>O,在温度为T1、T2时,平衡体系中N02的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2N02(g) △H>O,在温度为T1、T2时,平衡体系中N02的体积分数随压强变化曲线如图所示。下列说法正确的是( )

A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
(4)如果(3)中的反应达到平衡后,改变某一外界条件(不改变N204、N02的量),反应速率v与时间t关系如右图所示。图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中N02的含量最高的一段时间是 。
(14分)下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:

(1)已知该产业链中某反应的平衡表达式为:K= ,它所对应的化学反应为:
,它所对应的化学反应为:
(2)已知在一定温度下,各反应的平衡常数如下:
C(s)+C02(g)  2C0(g),K1
①
2C0(g),K1
①
CO(g)+H20(g)  H2(g)+C02(g),K2
②
H2(g)+C02(g),K2
②
C(s)+H20(g)  CO(g)+H2(g),K3 ③
CO(g)+H2(g),K3 ③
则K1、K2、K3,之间的关系是: ,反应①的平衡常数K随温度的升高而 (增大/减小/不变)。
一定温度下,在三个容积均为2L的容器中均进行着③反应,各物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。

简述理由:
(3)该产业链中氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如N0、N02、N204等。对反应N2O4(g)  2N02(g)
△H>O,在温度为T1、T2时,平衡体系中N02的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2N02(g)
△H>O,在温度为T1、T2时,平衡体系中N02的体积分数随压强变化曲线如图所示。下列说法正确的是( )

A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
(4)如果(3)中的反应达到平衡后,改变某一外界条件(不改变N204、N02的量),反应速率v与时间t关系如图所示。图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中N02的含量最高的一段时间是 。

(6分)某学生为测定未知浓度的硫酸溶液,以0.1400mol/L的NaOH溶液滴定上述H2SO4,取待测硫酸25.00mL,滴定终止时消耗NaOH溶液15.00mL。
(1)若使用甲基橙做指示剂,如何确定终点 (2) 下列操作将导致测定值高于实际值的是
A.标准液在“0”刻度线以上,未予调整就开始滴定
B.碱式滴定管用蒸馏水洗涤后未用标准NaOH溶液润洗
C.观察记录滴定管内液面刻度时滴定前仰视,滴定后俯视
D.酸滴定管经蒸馏水洗净后,即注入锥形瓶进行中和滴定
E.在滴定过程中不慎将数滴酸液滴在锥形瓶外
(3)计算待测硫酸溶液的物质的量浓度为 mol/L(计算出结果到小数点后二位)
(14分)下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
(1)已知该产业链中某反应的平衡表达式为:K=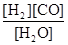 ,它所对应的化学反应为:
,它所对应的化学反应为:
(2)已知在一定温度下,各反应的平衡常数如下:
C(s)+C02(g)  2C0(g),K1 ①
2C0(g),K1 ①
CO(g)+H20(g)  H2(g)+C02(g),K2 ②
H2(g)+C02(g),K2 ②
C(s)+H20(g)  CO(g)+H2(g),K3 ③
CO(g)+H2(g),K3 ③
则 K1、K2、K3,之间的关系是: ,反应①的平衡常数K随温度的升高而 (增大/减小/不变)。
K1、K2、K3,之间的关系是: ,反应①的平衡常数K随温度的升高而 (增大/减小/不变)。
一定温度下,在三个容积均为2L的容器中均进行着③反应,各物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。
简述理由:
(3)该产业链中氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如N0、N02、N204等。对反应N2O4(g)  2N02(g) △H>O,在温度为T1、T2时,平衡体系中N02的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2N02(g) △H>O,在温度为T1、T2时,平衡体系中N02的体积分数随压强变化曲线如图所示。下列说法正确的是( )
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
(4)如果(3)中的反应达到平衡后,改变某一外界条件(不改变N204、N02的量),反应速率v与时间t关系如图所示。图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中N02的含量最高的一段时间是 。
一、1.AD 2.B 3.B 4.D 5.D 6.BC 7.C 8.A?
二、9.C4H10,C9H20或C10H8?
10.(1)CO、H2,物质的量相同,耗O2的量相同?
(2)C2H5OH,CH3―O―CH3,必须是同分异构体?
11.(1)CH≡CH,有机物分子式和结构式的确定.files/image071.jpg) ,(2)CH4,CH3OH
,(2)CH4,CH3OH
12.C5H12;设该烃的分子式为CxHy,则有有机物分子式和结构式的确定.files/image073.gif) =5/1则x/y=5/12所以分子式为C5H12
=5/1则x/y=5/12所以分子式为C5H12
13.(1)x=2,y=1 (2)C2H2O2 (3)18
14.(1)1≤V(O2)/V(C2H6)≤2.5?
当只有CO2与Na2O2反应时,则应通入的O2最多,由2C2H6+5O2+4Na2O2→4Na2CO3+6H2O(l)得V(O2)/V(C2H6)=5/2=2.5?
当C2H6燃烧后产生的CO2和H2O均全部与Na2O2反应时,则通入的O2应最少,由方程式C2H6+O2+5Na2O2→2Na2CO3+6NaOH得V(O2)/V(C2H6)=1/1
故O2与C2H6的体积比x的取值范围为1≤V(O2)/V(C2H6)≤2.5
(2)0.8?
n(Na2O2)=有机物分子式和结构式的确定.files/image075.gif) =0.02mol由
=0.02mol由
有机物分子式和结构式的确定.files/image077.gif) =
=有机物分子式和结构式的确定.files/image079.gif)
有机物分子式和结构式的确定.files/image081.gif) n(O2)=0.025mol故通入O2的质量不能超过
n(O2)=0.025mol故通入O2的质量不能超过
15.(1)n(H2O)=有机物分子式和结构式的确定.files/image083.gif) =0.6moln(CO2)=
=0.6moln(CO2)=有机物分子式和结构式的确定.files/image085.gif) =0.4mol?
=0.4mol?
CuO + CO = Cu + CO2 △m(减量)?
1mol
1mol
n(CO)
有机物分子式和结构式的确定.files/image081.gif)
有机物分子式和结构式的确定.files/image087.gif)
∴实际有机物燃烧产生的CO2为:0.4-0.2=0.2mol?
∴0.2mol有机物中含有机物分子式和结构式的确定.files/image087.gif)
有机物分子式和结构式的确定.files/image081.gif) 1mol有机物中C∶H∶O=2∶6∶2
1mol有机物中C∶H∶O=2∶6∶2
故有机物分子式为:C2H6O2?
(2)n(Na)=有机物分子式和结构式的确定.files/image090.gif) =0.4mol,0.2mol有机物能和0.4molNa反应
=0.4mol,0.2mol有机物能和0.4molNa反应
所以该有机物为二元醇,结构简式为HO―CH2―CH2―OH?
16.(1)有机物分子式和结构式的确定.files/image092.jpg)
2-甲基-1,3-丁二烯(或异戊二烯)?
(2)有机物分子式和结构式的确定.files/image094.jpg) ?聚异戊二烯?
?聚异戊二烯?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com