
题目列表(包括答案和解析)
求:(1)原混合物中各物质的质量各多少克?
(2)画出向混合液中加入硫酸时,消耗硫酸的体积V(mL)与产生沉淀的物质的量n(mol)的关系图。
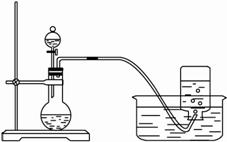
(1)将3.9 g过氧化钠放入烧瓶中,加入100 mLH2O,用排水法收集气体。?
①过氧化钠跟水反应的化学方程式为 。?
②集气瓶充满气体后,怎样从水槽中取出集气瓶?简述操作方法。?
。
(2)已知:酚酞在c(OH-)为1.0×10-4~2.5 mol·L-1时呈红色,且0.5 min内不会褪色;H2O2具有氧化性和漂白性。取上述实验得到的溶液于试管中,滴入2滴酚酞试液,溶液变红,片刻红色褪去。?
①有人认为,“红色迅速褪去”是由于溶液中c(OH-)过大造成的,试通过估算并对比数据加以说明。
。
②还有人认为,“红色迅速褪去”是因为溶液中存在H2O2。试设计实验证明烧瓶内的溶液中可能有H2O2存在。请简述实验操作。?
。?
③补充实验,证明“红色迅速褪去”与溶液中存在H2O2有关。请简述实验操作。?
。


| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g?cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |

| 高温 |
| 高温 |
| c(SO42-) |
| c(CO32-) |
| 催化剂 |
| △ |

化学能与电能之间的相互转化与人类的生活实际密切相关,在生产、生活中有重要的应用,同时也是学生形成化学学科素养的重要组成部分。
(1)熔融状态下,钠的单质和氯化亚铁能组成可充电电池,如图9-8工作原理示意图,反应原理为2Na+FeCl2 Fe+2NaCl,该电池放电时,正极反应式为________________________________________________________________________;
Fe+2NaCl,该电池放电时,正极反应式为________________________________________________________________________;
充电时,____________(写物质名称)电极接电源的负极;该电池的电解质为________。
(2)某同学用铜片、石墨作电极电解一定浓度的硫酸铜溶液,工作原理示意图如图所示,一段时间停止通电取出电极。若在电解后的溶液中加入0.98 g氢氧化铜粉末恰好完全溶解,经测定所得溶液与电解前完全相同。请回答下列问题:
①Y电极材料是________,发生________(填“氧化”或“还原”)反应。
②电解过程中X电极上发生的电极反应式是_______________________________________________________________________。
③如在电解后的溶液中加入足量的小苏打,充分反应后产生气体在标准状况下所占的体积是__________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com