
题目列表(包括答案和解析)
| 实验编号 | 温度(K) | 盐酸浓度(mol?L-1) | 醋酸浓度(mol?L-1) | 实验目的 |
| ① | 298 | 0.20 | a.实验①和②是探究 不同温度 不同温度 对镁与盐酸反应速率的影响;b.实验①和③是探究 不同浓度 不同浓度 对镁与盐酸反应速率的影响;c.实验①和④是探究相同温度下,相同浓度的盐酸、醋酸与镁反应速率的区别. | |
| ② | 308 | 0.20 | ||
| ③ | 298 | 0.40 | ||
| ④ | 298 298 |
0.20 0.20 |
| 1 |
| 2 |
| 实验编号 | 温度(K) | 盐酸浓度 | 醋酸浓度 | 实验目的 |
| ① | 298 | 0.20 | a.实验①和②是探究______对镁与盐酸反应速率的影响; b.实验①和③是探究______对镁与盐酸反应速率的影响; c.实验①和④是探究相同温度下,相同浓度的盐酸、醋酸与镁反应速率的区别. | |
| ② | 308 | 0.20 | ||
| ③ | 298 | 0.40 | ||
| ④ | ______ | ______ |
某探究小组同学用金属铝分别与稀盐酸或稀硫酸反应的方法研究金属与不同
酸反应的差异及影响反应速率的因素。
实验药品:2. 0moL/L盐酸、4. 0mol/L盐酸、2 .0mol/L硫酸、4.0mol/L硫酸,相同大小的铝片和铝粉(金属表面氧化膜都已除去);每次实验各种酸的用量均为50. 0mL,金属用量均为9. 0g。
甲同学用铝片分别和稀盐酸、稀硫酸反应,实验及其现象如下:
| 反应进程(分钟) | 1 | 2 | 5 | 15 | 20 |
| 4.0mol/L盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| 2.0mol/L硫酸 | 无明显现象 | 极少量气泡 | 少量气泡 | ||
| 4.0mol/L硫酸 | 无明显现象 | 少量气泡 | 有比较连续的气泡 | ||
请回答:(])写出铝与盐酸反应的离子方程式____________________________________
(2)反应1一15min内,铝与盐酸的反应速率逐渐加快,其原因是______________________
_______________________________________________________________
(3)根据以上探究“铝与稀盐酸和稀硫酸反应差异的原因”,你能对问题原因作出哪些
假设或猜想(列出一种即可)?____________________________________________________
乙同学设计了如下影响反应速率因素的实验。请你根据实验目的帮助该同学完成以
 下实验设计表
下实验设计表
| 实验目的 | 实验 编号 | 温度 | 金属铝 形态 | 盐酸浓度 /mol·L-1 |
| 1. 实验①和②探究盐酸浓度对该反应速率的 影响; 2. 实验①和③探究温度对该反应速率的影响; 3. 实验①和④探究金属规格(铝片,铝粉)对该反应速率的影响; | ① | 25˚C | 铝片 | 4. 0 |
| ② | ||||
| ③ | ||||
| ④ |
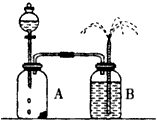
(10分)![]() 同学们为了探究镁条与盐酸、醋酸反应时浓度或温度对反应速率(观察镁条消失的时间)的影响,他们准备了以下化学用品:0.20mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298K或308K。
同学们为了探究镁条与盐酸、醋酸反应时浓度或温度对反应速率(观察镁条消失的时间)的影响,他们准备了以下化学用品:0.20mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298K或308K。
(1)该实验缺少的仪器是 。
(2)酸液都取足量、相同体积,请你帮助完成以下面实验设计表:
实验
| 温度(K) | 盐酸浓度
| 醋酸浓度(mol?L-1) | 实验目的 |
① | 298 | 0.20 |
| a.实验①和②是探究 对镁与盐酸反应速率的影响;
|
② | 308 | 0.20 |
| |
③ | 298 | 0.40 |
| |
④ |
| 0.20 |
|
(3)预测:相同温度、相同浓度时,刚开始时两者产气的速率盐酸 醋酸(“填:=、>、<”),镁条最先消失的是 ;如果镁条足量时,选pH相同、等体积的盐酸和醋酸,产气最多的是 。
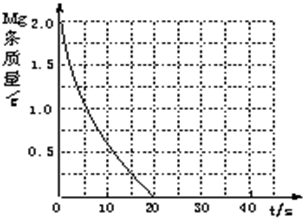
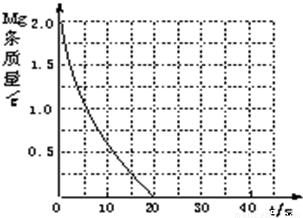
(4)若(2)中实验①镁条消失的时间是20s,则镁条剩余质量与时间关系图如右图。假设:该反应温度每升高10℃,反应速率是原来的2倍;温度相同时,醋酸是相同浓度盐酸平均速度的1/2,请你在此图中大致画出“实验②”(用实线)、“实验④中醋酸实验”(用虚线)的镁条质量与时间关系曲线。
1.C 2.A、C 3.D 4.C 5.B、D 7.AB 8.C 9.A 10.AD 11.CD
12.B 13.C 14.C 15.C 16.C 17.D 18.C 19.D 20.C 21.D 22.B
23.本题考查学生称量、加热、溶解、结晶等基本操作,同时要求理论联系实际确定有关化学方程式和计算溶解度.
通过计算知:用50 mL 70℃热水与24 gKCl制几乎饱和的溶液,再用25 mL 70℃热水与 配制成饱和溶液,将此两种溶液混合、搅匀、静止、冷却,将陆续析出
配制成饱和溶液,将此两种溶液混合、搅匀、静止、冷却,将陆续析出 晶体,至20℃时,减压过滤使
晶体,至20℃时,减压过滤使 分离出来.
分离出来.
24.(1)无机酸酯

(2)X可能是沸石(或碎瓷片);防止暴沸
(3)回流冷凝易挥发的反应物:a;b
(4)用足量水洗涤,分液除去乙醇,加稀NaOH溶液,分液除去碘.
25.(1)C→B→D→A→G→H→E→F
(2)使漏斗下端管口紧靠烧杯内壁;及时关闭活塞,不要让上层液体流出;使漏斗内外空气相通以保证(G)操作时漏斗里液体能够流出.
(3) 与水不互溶;而且碘在
与水不互溶;而且碘在 中的溶解度比在水中大很多.
中的溶解度比在水中大很多.
(4)A、C
提示:(4)热裂汽油中含有不饱和气态烃如丙烯、丁烯与溴发生加成反应.
26.(1)AEF (2)AB (3)AF(或AEF) (4)D (5)安全瓶防止碱液倒吸
27.(1)4 a、d、f、h h吸收 吸收
吸收 天平
天平
(2)试样质量=碳元素质量+氢元素质量为烃
试样质量>碳元素质量+氢元素质量为烃的含氧衍生物
(3)B
28.(1)
(2)碱石灰;无水 只能吸水,不能吸收
只能吸水,不能吸收 .
.
(3) (或
(或 )
)
(4) ;放热;反应开始后断开电键K,铂丝能继续保持红热.
;放热;反应开始后断开电键K,铂丝能继续保持红热.
(5)气体颜色变浅; 发生反应:
发生反应:

 ,属于放热反应,达到平衡后,若降低温度,平衡向右移动,
,属于放热反应,达到平衡后,若降低温度,平衡向右移动, 浓度减少,
浓度减少, 浓度增大,而
浓度增大,而 无色,所以气体颜色变浅.
无色,所以气体颜色变浅.
29.本题考查学生乙炔的制取方法、干燥、氧化原理及产物的吸收测定顺序.由于制得的乙炔气含水对燃烧及产物测定有影响,故制得的乙炔气体必须先干燥,然后再进行题中的催化氧化,乃至测定产物的质量.所以(1)G、E、F、H、I、C、D、A
(2)吸收燃烧产生的 气体;吸收产生的水蒸气;吸收乙炔中的水蒸气.
气体;吸收产生的水蒸气;吸收乙炔中的水蒸气.
(3)

(4)
30.解析:过程如下:


答案:①将废水过滤,目的是除去其中的悬浮泥沙等不溶物;
②往①的滤液中加入足量锌粉,将其中的 置换出来;
置换出来;
③过滤②中的不溶物,滤出Ag和过量的锌粉;
④往③的滤渣中加入过量的稀硫酸,使其中的锌粉转化为 而进入溶液;
而进入溶液;
⑤过滤,将④中没溶解的Ag滤出回收;
⑥将③、⑤得到的滤液合并,蒸发浓缩,使 析出后回收.
析出后回收.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com