
题目列表(包括答案和解析)
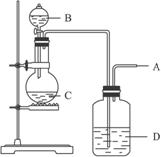
(1)A是________。
(2)若C是一种淡黄色固体,则烧瓶中发生的化学方程式为:________________________。
(3)若C是一种黑色粉末, 则B物质是_________,C物质的作用是____________________。
(4)洗气瓶中的试剂是_________,其作用是_______________________________________。
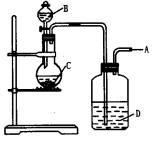
(1)A是_____________。
(2)若C是一种淡黄色固体,则烧瓶中发生反应的化学方程式 为___________________。
(3)若C是一种黑色粉末,则B物质是________,C物质的作用是_________________。
(4)洗气瓶中的试剂是________,其作用是________。
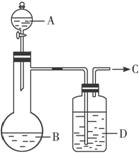
(1)C气体是____________。
(2)若B是一种淡黄色固体,则烧瓶中发生反应的化学方程式为________________________。
(3)若B是一种黑色粉末,则A液体是________,B物质的作用是______________________。
(4)洗气瓶中的D液体是____________,作用是__________________________________。
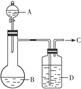
为了制取干燥纯净的气体C,可用如下图所示装置。生成C的速度可通过调节滴入液体A的速度的方法来控制,已知C是一种无色无味、不能使酸碱指示剂变色,也不会在空气中燃烧的气体。
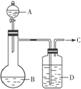
(1)C气体是____________。
(2)若B是一种淡黄色固体,则烧瓶中发生反应的化学方程式为________________________。
(3)若B是一种黑色粉末,则A液体是________,B物质的作用是______________________。
(4)洗气瓶中的D液体是____________,作用是__________________________________。
一、1.解析:钠的焰色反应为黄色,钾的焰色反应为淡紫色,在观察钾的焰色时必须排除黄光的干扰。?
答案:D?
2.D?
3.解析:组成要符合(CO)n(H2)m的形式?
答案:D?
4.BC 5.C 6.D 7.C 8.C?
二、9.解析:在A中:1 mol NaHCO3分解生成0.5 mol CO2和0.5 mol H2O和0.5 mol Na2CO3,若先考虑0.5 mol CO2与Na2O2反应则有2CO2+2Na2O2===2Na2CO3+O2,故消耗0.5 mol Na2O2,生成0.5 mol Na2CO3,然后0.5 mol H2O和0.5 mol Na2O2刚好完全反应生成1 mol NaOH,故因为Na2CO3和NaOH不反应,结果相同,但应注意,若CO2过量,则CO2可和生成NaOH反应,而转化为H2O过量,因此通常在定量条件下先考虑CO2和Na2O2的反应情况。
答案:A.1 mol Na2CO3、1 mol NaOH B.1 mol Na2CO3 C.1 mol CaCO3、 1 mol Na2CO3 C>A>B?
10.(1)4KO2+2CO2===2K2CO3+3O2↑?
(2)0.61∶1 (3)1∶3?
(4)KO2 因等质量的KO2与CO2反应时放出的O2的量更多?
11.(1)O2?(2)2Na2O2+2H2O===4NaOH+O2↑?
(3)H2O2 催化剂 (4)浓H2SO4 干燥氧气?
12.4KO2+2CO2===2K2CO3+3O2?4RbO3+2CO2===2Rb2CO3+5O2 AB?
13.(1)0.5A (2)0.75A?
(3)0<x<0.5时,y=0.5A;0.5≤x<1时,y=xA

14.(1)2HCl+CaCO3===CaCl2+H2O+CO2↑ CO2+NaOH===NaHCO3?
(2)0.5 mol NaOH?
(3)称取20 g NaOH放入烧杯中,加100 g H2O,不断搅拌,使之溶解,等冷却后,通入过量CO2气体。过滤,用滤纸将滤渣表面的水吸干。?
(4)A点标注略 0.125 mol 正盐?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com