
题目列表(包括答案和解析)
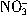 浓度为0.2 mol?L-1
浓度为0.2 mol?L-1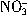 总数为0.2 NA
总数为0.2 NA设NA为阿伏加德罗常数的值,下列关于0.2 mol?L -1 Ba(NO3)2溶液的说法不正确的是
A.2L溶液中阴、阳离子的总数为1.2NA
B.500mL溶液中NO3-的浓度为0.2 mol?L -1
C.500mL溶液中Ba2+的浓度为0.2 mol?L -1
D.500mL溶液中NO3-的总数为0.2NA
设NA为阿伏加德罗常数的值,下列关于0.2 mol?L -1 Ba(NO3)2溶液的说法不正确的是
A.2L溶液中阴、阳离子的总数为1.2NA
B.500mL溶液中NO3-的浓度为0.2 mol?L -1
C.500mL溶液中Ba2+的浓度为0.2 mol?L -1
D.500mL溶液中NO3-的总数为0.2NA
一、1.解析:设原溶液中水的质量为w g,R的质量为 m g,R的溶解度为S g,则有:

根据比例性质,可设:?

S= ×100=
×100=
答案:B?
2.解析:注意体积效应。?
答案:B?
3.解析:因H2SO4溶液的密度随浓度增大而增大,是一个变值而不是一个定值。设稀释后溶液密度为ρ′,则有:18× ×10-3=9×
×10-3=9× ×10-3,2
×10-3,2 =
= ,因为
,因为
ρ′<ρ,故V<100(mL)。
答案:A?
4.解析:NH3+2O2===HNO3+H2O?
HNO3%= ×100%=78%
×100%=78%
答案:A
5.AB 6.B 7.B 8.D 9.C?
二、10.
11.
 g
g
12.(1)G、E、C、H、F(或E、G、C、H、F)?
(2)BCD
14.(1)0.0813 mol?L-1 (2)32 mL?
15.(1)四种?
①KOH,K2CO3 ②K2CO3 ③K2CO3,KHCO3?④KHCO3?
(2)解:2KOH+CO2 === K2CO3+H2O?
22.4 138?
2.24 x=13.8?
KOH+CO2===KHCO3?
22.4 100?
2.24 x=10.0?
从上面两方程知:生成的固体全部是K2CO3时应该是 =0.100 mol
=0.100 mol
若K2CO3为a mol,则KHCO3为(0.100-a)mol?
则得方程
即K2CO3和KHCO3各为0.050 mol?
K2CO3为:
KHCO3为:
依K+守恒的要求,设KOH溶液浓度为c则:?
0.300 Lc=0.050 mol×2+0.050 mol c=0.50 mol?L-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com