
题目列表(包括答案和解析)
 金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重,寻求防止钢铁腐蚀的方法意义重大.
金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重,寻求防止钢铁腐蚀的方法意义重大.| 1 |
| 5 |
| 2 |
| 9 |
| 1 |
| 4 |
| 1 |
| 3 |
| 1 |
| 2 |
金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重,寻求防止钢铁腐蚀的方法意义重大.
(1)钢铁的表面发蓝、发黑处理是常用的防腐方法.下列反应是主要反应之一.
请配平方程式:□Na2FeO2+□NaNO2+□________=□NaFeO2+□NH3↑+□NaOH
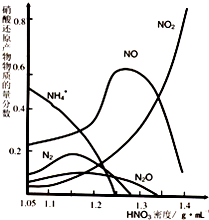
(2)钢铁的“钝化”处理也能达到防腐目的,经冷、浓HNO3处理后,其表面有一层致密氧化物保护膜,但是加热或在稀HNO3中就不能“钝化”.不同浓度的HNO3与铁反应的还原产物很复杂,其分布曲线如图.
①图示可知,密度为1.05 g·mL-1的硝酸与铁反应时,其最多的还原产物是________;密度大于1.35 g·mL-1的硝酸与铁反应时,其还原产物主要是NO2;分析HNO3与铁反应的规律是:__________________________.
②mg铁与含n gHNO3的硝酸溶液恰好完全反应,若硝酸的还原产物只有NO,则m的取值可能是________(填字母编号)
A.![]()
B.![]()
C.![]()
D.![]()
E.![]()
③工业上一般不用冷浓硝酸进行铁表面处理,其可能的原因是:________.
(3)金属(M)的腐蚀是因为发生反应:M-ne-→Mn+,除了上述表面处理的方法外,下列方法也能起到防腐作用的是________(填字母编号)
A.在铁中掺入铭、镇等金属,改变其内部结构,制成不锈钢
B.在铁制品表面镀辞
C.提高铁中含碳量,制成生铁
D.将水库铁闸门与直流电源的负极相连
I.设反应①Fe(s)+CO2(g) FeO(s)+CO(g)的平衡常数为K1。反应 ②Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1。反应 ②Fe(s)+H2O(g)  FeO(s)+H2(g)的平衡常数为K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g)的平衡常数为K2,在不同温度下,K1、K2的值如下:
| T(K) | K1 | K2 |
| 973 | 1.47 | 2.36 |
| 1173 | 2.15 | 1.67 |
 CO(g)+H2O(g),这是一个 (填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有 (填序号)。
CO(g)+H2O(g),这是一个 (填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有 (填序号)。 FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)
FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)  FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率 (填序号)。
FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率 (填序号)。
 FeO(s)+CO(g)的平衡常数为K1。反应 ②Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1。反应 ②Fe(s)+H2O(g)  FeO(s)+H2(g)的平衡常数为K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g)的平衡常数为K2,在不同温度下,K1、K2的值如下:| T(K) | K1 | K2 |
| 973 | 1.47 | 2.36 |
| 1173 | 2.15 | 1.67 |
 CO(g)+H2O(g),这是一个 (填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有 (填序号)。
CO(g)+H2O(g),这是一个 (填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有 (填序号)。 FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)
FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)  FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率 (填序号)。
FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率 (填序号)。
I.设反应①Fe(s)+CO2(g) FeO(s)+CO(g)的平衡常数为K1。反应 ②Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1。反应 ②Fe(s)+H2O(g)  FeO(s)+H2(g)的平衡常数为K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g)的平衡常数为K2,在不同温度下,K1、K2的值如下:
|
T(K) |
K1 |
K2 |
|
973 |
1.47 |
2.36 |
|
1173 |
2.15 |
1.67 |
(1)现有反应③CO2(g)+H2(g)  CO(g)+H2O(g),这是一个 (填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有
(填序号)。
CO(g)+H2O(g),这是一个 (填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有
(填序号)。
A.缩小反应容器容积
B.扩大反应容器容积
C.降低温度
D.升高温度
E.使用合适的催化剂
F.设法减少CO的量
(2)若反应Fe(s)+CO2(g)  FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)
FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)
 FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率 (填序号)。
FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率 (填序号)。
A.前者大 B.后者大 C.一样大 D.无法判断
II.(1)钢铁的表面发蓝、发黑处理是常用的防腐方法。请配平主要反应的方程式:
□Na2FeO2+□NaNO2+□H2O=□NaFeO2+□NH3↑+□NaOH
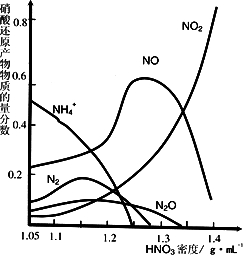
(2)钢铁经冷、浓HNO3处理后“钝化”能达到防腐目的,不同浓度的HNO3与铁反应的还原产物很复杂,其分布曲线如图。

①图示可知,分析HNO3与铁反应的规律是 。
②工业上一般不用冷浓硝酸进行铁表面处理,其可能的原因是 。
(3)金属(M)的腐蚀是因为发生反应:M-ne-→Mn+,除了上述表面处理的方法外,下列方法也能起到防腐作用的是 (填字母编号)
A.在铁中掺入铬等金属制成不锈钢
B.在铁制品表面镀锌
C.提高铁中含碳量,制成生铁
D.将水库铁闸门与直流电源的负极相连
一、选择题(1~10小题,每小题3分,共30分;11~20小题最多两个答案,每小题4分,答对一个得2分,答对两个得4分,但只要答错一个得0分)
题号
1
2
3
4
5
6
7
8
9
10
答案
D
B
A
B
D
A
C
D
A
D
题号
11
12
13
14
15
16
17
18
19
20
答案
AD
A
D
D
BD
C
BC
AD
B
A
三、(共30分)
21、(7分)(1)CH3-O-CH2-OH CH2OH-CH2OH (各1分,共2分)
(2)(各1分,共2分。预期生成H2的体积与对应X的结构简式都对才得1分,只答对一部分不得分;体积没有单位合并扣1分,单位用毫升表示不扣分)
实验原理
预期生成H2的体积(标况)
对应X的结构简式
取
1.
CH3-O-CH2-OH
2.
CH2OH-CH2OH
(3)(3分,装置可参考图示1或2,其它如附图的合理答案也得分。进气管和出水管的顺序颠倒扣1分)
 |
|||||
 |
|||||
 |
|||||
图示1 图示2
 |
|||
 |
|||

22、(12分)(1)11.76~11.78均得分 (1分) (2)Na2CO3 和NaHCO3 (1分)因为第一滴定终点所用体积小于第二滴定终点所用体积或V1<(V2-V1)或计算说明 (2分)
(3)以防滴定过快使Na2CO3直接生成H2CO3 (2分)
(4)碱样的总碱量为:
n(Na2O)= [(25.02mL +24.98 mL)/2]×10
(5)直接以溴甲酚绿-二甲基黄或甲基橙为指示剂滴定至终点 (3分)
23、(11分)(1)便于硫被水浸润 (2分)
(2)Na2SO4(1分) 取少量溶液,加稀盐酸酸化后,过滤,再加BaCl2溶液 (2分)
(3)玻璃棒、漏斗、烧杯 (2分);用乙醇或CS2浸没滤渣,等自然流下后,重复几次(2分)。(用水洗涤不得分)
(4)温度应低于
四、(共30分)
24.(11分)(1)NaOH、NaAl(OH)4(NaAlO2)、Na2SiO3 [或氢氧化钠、铝酸钠(偏铝酸钠)、硅酸钠](1分)
(2)CO2+2OH-==HCO3-+2H2O (1分) ,CO2+3H2O+2AlO2-==2Al(OH)3↓+2H2O-+CO32- (1分)
(3) bac (2分) ;
(4)2H2O+2e-→2OH-+H2↑(2分) ;Al(OH)3 +OH-=Al(OH)4- 或Al(OH)3 +OH-=AlO2-+2H2O (2分)
 (5)(2分)
(5)(2分)
25 (8分)
(1)(3分)
V正 < V逆(1分)
0.40(2分)
(2)25%(1分);不变(1分);1:a(1分); (3)-78.7 (2分)
26(11分)(1) (2分)
(2分)
(2)①NH3 或NH4+ (1分);其规律是:硝酸的浓度越大,其还原产物中氮元素化合价越高。(2分)
(其它合理答案均给分。如硝酸的浓度越大,气体生成物中二氧化氮的含量越高;或者,只在硝酸浓度较低时,产物中才会出现氮气。等等)
②B、C、D (对一个或两个给一分,全对2分,但只要出现A、E便不给分) (2分)
③硝酸易挥发,且不稳定,见光易分解,故不易操作;生成物对环境污染严重 (2分)
(3)A.B.D.(2分)(对一个或两个给一分,全对2分,但只要出现C便不给分)
五、(共10分)
27. (共10分) (1)BCD;(共2分,答对两个给1分全对给2分,错选A倒扣1分,答ABCD为0分)
(2)能与羧酸发生酯化反应(或其它合理的答案均可);(2分)
(3)CH3COOH;(2分,写结构式不给分)
(4)AC;(2分,选对一个给一分,错选一个倒扣一分,扣完本小题分为止)
(5)CH2=CH2 + Br2 → CH2Br―CH2Br;(2分,有机物写分子式不给分、写结构式给分,“→”写“=”不给分)
六、选做题(共10分)
28. (共10分)
 |
(1) (2分),取代反应(或酯化反应);(1分)
 |
(2)
(2分,有机物写分子式不给分、写结构式给分,
“→”写“=”扣1分,反应条件错写或漏写扣1分)
(3)b、c、d;(2分,选对两个给1分,选对三个给2分,错选为0分)
 (4)(3分,路线有误或不全者不给分,条件不全或有误者扣一分,其它合理答案酌情给分)
(4)(3分,路线有误或不全者不给分,条件不全或有误者扣一分,其它合理答案酌情给分)
 |
或者
29.(共10分)
(1)LaNi5 + 3H2  LaNi5H6;(2分,不配平不给分,化学式不正确不给分,可逆符号写等号扣一分)
LaNi5H6;(2分,不配平不给分,化学式不正确不给分,可逆符号写等号扣一分)
(2)CE (2分,每选对一个给一分,每错选一个倒扣一分,扣完本小题分为止)
(3)①[Ar]3d7;或 (2分,写成3d7不给分)
(2分,写成3d7不给分)
②2NiO(OH) + 6HCl(浓)=2NiCl2+Cl2↑+4H2O;(2分,未配平不给分,氯气未写气体符号扣一分)
(4)A和B(或A和C、A和D、B和E、C和E、D和E任一组均可);(2分,若同组中出现同种物质则不给分,例如AE、BC……等)
www.ks5u.com
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com