
题目列表(包括答案和解析)
过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等。请回答相关问题:
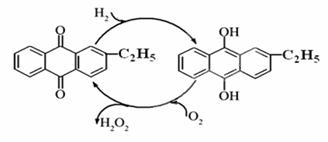
(1)目前常用乙基蒽醌法制备过氧化氢,主要过程如下图,此过程的总方程式为 。
(2)实验测得常温下质量分数为0.51%H2O2水溶液(密度为1g/mL)的pH为5
i.写出H2O2溶于水的电离方程式 .
ii.测定H2O2水溶液pH的方法为(填编号)
A.用酸碱指示剂测定 B.用广泛pH试纸测定
C.用精密pH试纸测定 D.用pH计测定
(3)某实验小组拟研究浓度、催化剂、溶液酸碱性对H2O2分解反应速率的影响。在常温下按照如下方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2% H2O2溶液 | 无 |
| ② | 10 mL 5% H2O2溶液 | 无 |
| ③ | 10 mL 5% H2O2溶液 | 0.1gMnO2粉末 |
| ④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 0.1gMnO2粉末 |
| ⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 0.1gMnO2粉末 |
i.实验①和②的目的是_______。实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2较稳定,不易分解。为了达到实验目的,你对原实验方案的改进是_________。
ii.实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图所示。
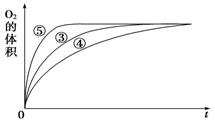
分析该图能够得出的实验结论是____________。
(4)实验室常用酸性高锰酸钾标准溶液测定双氧水的浓度,反应原理为:
MnO4-+H2O2+H+ —Mn2++H2O+ O2↑
i.请配平以上离子方程式
ii.用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗0.1000 mol·L-1的KMnO4标准溶液体积如下表所示:
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
计算试样中过氧化氢的浓度为 mol·L-1。
iii.若滴定前尖嘴中有气泡滴定后消失,则测定结果 (“偏高”或“偏低”或“不变”)。
化学学习小组为测定某补血剂中硫酸亚铁的含量进行了以下探究:
查阅资料:本品为糖衣片,除去糖衣后显淡蓝绿色,主要成分硫酸亚铁(FeSO4·7H2O).
5Fe2++MnO![]() +8H+=5Fe3++Mn2++4H2O
+8H+=5Fe3++Mn2++4H2O
实验步骤:取本品10片,在适当的条件下配成100 mL溶液,分别准确量取20 mL溶液,用下列两种方法进行实验:
方法一:用一定物质的量浓度的酸性高锰酸钾溶液滴定.
方法二:加过量H2O2溶液,然后再加入过量NaOH溶液,得红褐色沉淀,将沉淀过滤并充分加热得红棕色固体,称量该固体的质量.
请回答下列问题:
(1)方法一中,配制一定物质的量浓度的酸性高锰酸钾溶液时,所需要的玻璃仪器除量筒、玻璃棒、胶头滴管、烧杯外还有________.
(2)方法二中,加过量H2O2溶液的目的是________.有的同学认为使用新制氯水也能达到此目的,写出反应的离子方程式________,和使用新制氯水相比,用H2O2溶液的好处是________.
(3)在方法一中,若每消耗1 mL酸性高锰酸钾溶液相当于0.152 g FeSO4,则该溶液中高锰酸钾的物质的量浓度是________.
在方法二中,若称得红棕色固体的质量为a g,则每片补血剂含FeSO4________g.
化学学习小组为测定某补血剂中硫酸亚铁的含量,进行了以下探究:
【查阅资料】本品为糖衣片,除去糖衣后显淡蓝绿色,主要成分硫酸亚铁(FeSO4·7H2O)。2KMnO4+10FeSO4+8H2SO4 = K2SO4+2MnSO4+5Fe2(SO4)3+8H2O
【实验步骤】取本品10片,在适当的条件下配成100 mL溶液,分别准确量取20 mL溶液,用下列两种方 法进行实验:
方法一:用一定物质的量浓度的酸性高锰酸钾溶液滴定。
方法二:加过量H2O2溶液,然后再加入过量NaOH溶液,得红褐色沉淀,将沉淀过滤并充分加热得红棕 色固体,称量该固体的质量。 请回答下列问题:
(1)方法一中,配制一定物质的量浓度的酸性高锰酸钾溶液时,所需要的玻璃仪器除量筒、玻璃棒、胶头滴管、烧杯外还有___________________。
(2)方法二中,加过量H2O2溶液的目的是_______________。有的同学认为使用氯气也能达到此目的,和使用氯气相比,用H2O2溶液的好处是_____________。
(3)在方法一中,若每消耗1 mL酸性高锰酸钾溶液相当于0.152 g FeSO4,则该溶液中高锰酸钾的物质的量浓度是___________。在方法二中,若称得红棕色固体的质量为a g,则每片补血剂含FeSO4 _______________g。
(11分)过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等。某化学兴趣小组同学围绕着过氧化氢开展了调查研究与实验。
Ⅰ.调查
(1)通过查阅资料,发现过氧化氢的沸点为152.1℃,而相对分子质量相同的硫化氢的沸点为-60.4℃,造成两者沸点差异大的主要原因是 ;
(2) 资料显示,过氧化氢制备目前最常用的是乙基蒽醌法,其主要过程可以用如图所示,写出此过程的总反应方程式是 。
Ⅱ.不稳定性实验研究
(3)为了探究温度、催化剂等外界条件对H2O2的分解速率的影响,某兴趣小组同学设计了如下三组实验,部分实验数据已经填在下面表中。
| 实验编号 | T/℃ | H2O2初始浓度/ mol·L-1 | FeCl3初始浓度/ mol·L-1 |
| Ⅰ | 20 | 1.0 |
|
| Ⅱ | 50 | 1.0 | 0 |
| Ⅲ | 50 |
| 0.1 |
①实验Ⅰ、Ⅱ研究温度对分解速率的影响,则实验Ⅰ中FeCl3初始浓度应为 mol·L-1,实验Ⅱ、Ⅲ研究催化剂对分解速率的影响,则实验Ⅲ中H2O2初始浓度应为 mol·L-1。
②三组实验中分解速率最快的是 (填编号)。
Ⅲ.过氧化氢含量的实验测定
兴趣小组同学用0.1000 mol·L-1酸性高锰酸钾标准溶液滴定试样中过氧化氢的含量,反应原理为:2MnO4-+5H2O2+6H+ =2Mn2++8H2O+ 5O2
(4)滴定到达终点的现象是__________________________________________________。
(5)用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗的 KMnO4标准溶液体积如下表所示:
|
| 第一次 | 第二次 | 第三次 | 第四次 |
| 体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
计算试样中过氧化氢的浓度为 mol·L-1。
(6)若滴定前尖嘴中有气泡,滴定后消失,则测定结果 (“偏高”或“偏低”或“不变”)。
一、选择题:
1、C 2、C 3、B 4、A 5、D 6、B 7、A 8、A 9、D 10、C
11、D 12、D 13、D
二、不定向选择题:
14、D 15、C 16、CD 17、AC 18、AD 19、AD 20、D 21、B
三必答题:
22、(15分)(1)71.4(3分),(2)1.47V(2分),0.73Ω(2分)
(3)①(S4 ―S1)/3t2(2分),②B(3分),
③(a)沙及沙桶质量m过大或M远大于m没有满足 (2分)
(b)平衡摩擦过分。(2分)
23、(15分)解:
(1)由牛顿第二定律得到Kmg―mg=ma(3分)
解得当K=4时,a1=
所以飞船在竖直向上发射时的加速度值的变化范围为
(2)由万有引力定律和牛顿第二定律得到GMm/(R+H)2=mV2/(R+H)(4分)
在地面物体受到的重力约为万有引力,即GM/R2=g(3分)
两式联立解得V=.files/image070.gif) =7.
=7.
24.(17分)解:.files/image072.gif)
(1)因粒子垂直地打到屏PQ上的某一点,所以该粒子一定是从M板的边缘进入磁场区域的,可知M板带正电,N板带负电。(2分)
(2)粒子在电场中运动时由运动学公式得
L=V0t (2分) L/2=at2/2=VYt/2(2分) 解得VY=V0 (1分)
所以V=.files/image074.gif) =
=.files/image076.gif) V0 (1分) 方向向右偏上α角,tanα=1,α=45°(1分)
V0 (1分) 方向向右偏上α角,tanα=1,α=45°(1分)
(3)粒子在磁场中运动时由几何关系得d/R=sin45°圆运动半径R=.files/image076.gif) d(2分)
d(2分)
由运动定律和运动学相关公式得到.files/image076.gif) BqV0=m(
BqV0=m(.files/image076.gif) V0)2/R(2分)
V0)2/R(2分)
解得q/m=V0/Bd(1分)
(4)由动能定理得qU/2=mV2/2 ―mV02/2 (2分) 解得U=mV02/2q=BdV0/2(1分)
25.本题共14分。方程式未配平的扣1分
(1)O2+4e +2H2O=4OH-(2分) (2)32(2分)
(3)2Fe3++Cu=2Fe2++Cu2+(2分)
(4)防止Fe2+被氧化(1分) ①抑制FeSO4水解(1分)
②2;10;8;5;2;1;8(2分)
③酸(1分); 紫(或紫红)(1分) ④0.02 mol/L(2分)
26.本题共14分
(1)1.6×
(3)①15~20 min(1分)和25~30 min(1分)②增加了O2的量(1分)③ab(2分)
27.本题共15分。方程式未配平的扣1分。
(1)6.25(2分) (2)①圆底烧瓶(1分);
.files/image080.gif) 安全管(或:防止装置中压力过大而发生危险;防止冷却时发生倒吸)(2分);
安全管(或:防止装置中压力过大而发生危险;防止冷却时发生倒吸)(2分);
NH+4+OH- NH3↑+H2O(2分); B(1分)
②消除其它试剂、实验操作等因素引起的误差(2分)
③(NH4)2B4O7+2HCl+5H2O=4H3BO3+2NH4Cl(2分)
④32.00(1分); 4.480(2分)
28、(26分)回答下列I、II题:
I、(每空1分)(1)转录和翻译
(2)B细胞和记忆(B)细胞(漏答或答错均不得分)
(3)注射抗原(疫苗) 可刺激家禽体内产生相应的抗体和记忆细胞
Ⅱ、(22分)(1)2n(3分)
(2)基因通过控制酶的合成来控制代谢,进而控制生物性状(3分)
(3)①×④(3分) ②×⑤(3分)
(4)AaXBY、AaXBXb(3分)
(5)由于残翅性状不利于果蝇生存,在自然选择的作用下,残翅基因的频率较低,因而
残翅果蝇数量较少(3分)
(6)实验步骤:让这只黑体雄果蝇与正常黑体雌果蝇(未用添加剂饮料喂过)
交配(2分),将孵化出的幼虫用正常饲料(不含添加剂)喂养,其它条件适当,
观察果蝇体色状况(2分)
29、(13分每空1分) (2)热能 升高
(4) ③备用的葡萄糖溶液 ④适量的酵母菌培养液和液体石蜡油 与A等量的酵母菌培养液 与A等量的蒸馏水
(5) 升高少 酵母菌在无氧条件下无氧呼吸放出的能量少
升高多 酵母菌在有氧条件下有氧呼吸释放的能量多
不升高 无酵母菌没有呼吸作用释放能量
(6)酵母菌的细胞呼吸方式包括有氧呼吸和无氧呼吸两种,有氧呼吸比无氧呼吸释放的能量多
四、选答题:
30、【物理-----选修2―2】
(1)C (6分)
(2)(9分)解:由有固定转动轴物体的平衡条件得
m1gL/2+m2gd=FLSin530 (5分) 解得(1分)
F的大小逐渐增大(3分)
31、(1)AD
(2)(9分)解:由理想气体状态方程得
P1 (H1―h)/T1=P2H2/T2(4分)
由题意得P1 =P0 ―h (2分) P2=P0+(H2―H1)(2分)
解得T2=480k,∴t2=
32、(1)C(6分)(2)(9分)解;
①由折射定律得到 Sini/Sinγ=1/n(2分) 解得n=.files/image076.gif) (1分)
(1分)
②由SinC=1/n(1分) 解得C=450(1分)
向下移动L1=R Sin450―R Sin300=(.files/image076.gif) ―1)R/2(2分)
―1)R/2(2分)
向下移动L2=R Sin450+R Sin300=(.files/image076.gif) +1)R/2(2分)
+1)R/2(2分)
33、【物理-----选修3―5】
(1)AB(6分)
(2)(9分)解:由动量守恒定律得m(L―X)=MX
解得X=mL/(M+m)(3分)
所以人和船对地的位移大小分别为ML/(M+m)和mL/(M+m)(1分)。
由能量守恒可知此过程人做的功等与人、船的动能之和
所以有W=mV2/2+MU2/2(2分)
又由动量守恒定律得mV=MU(2分)
联立解得W=mV2/2+MU2/2=.files/image084.gif) (1分)
(1分)
.files/image085.gif) 34.本题共15分。方程式未配平的扣1分。
34.本题共15分。方程式未配平的扣1分。
(1)①CaCO3 CaO+CO2↑(2分)(2)Mg2++2e-=Mg(2分)
(3)蒸发皿(1分)、玻璃棒(1分) (4)提高Mg2+的浓度,起到富集的作用(2分)
(5)在HCl气流中(1分); 抑制MgCl2水解生成Mg(OH)2(1分),带走水蒸气(1分)
(6)abd(2分,部分选对给1分,选错不给分)
(7)BaCl2、Na2CO3、NaOH(或BaCl2、NaOH、Na2CO3;NaOH、BaCl2、Na2CO3)(2分)
35.本题共15分
(1)O(2分)
(2)SiO2(1分); SiO2是原子晶体,微粒间的作用力为共价键(1分);CO2是分子晶体,微粒间的作用力为范德华力(1分)。故SiO2的熔点高于CO2。
(3)N(1分); N的2p能级为半充满状态的2p3,是稳定结构(1分),而O的2p能级为2p4,是不稳定结构(1分)。故N的第一电离能高于O。
(4)V型(或角型)(2分); sp2杂化(2分)
(5)Cu(1分); 1s22s22p63s23p63d104s1或[Ar]3d104s1(2分)
36.本题共15分
(1).files/image086.gif)
.files/image087.gif) (2分) (2)取代反应(1分)
(2分) (2)取代反应(1分)
(3).files/image088.gif)
.files/image089.gif) +CO2+H2O→
+CO2+H2O→.files/image090.gif)
.files/image091.gif) +NaHCO3(2分);
+NaHCO3(2分);
CH3COOH+C2H5OH.files/image093.gif)
.files/image094.gif) CH3COOC2H5+H2O(2分)
CH3COOC2H5+H2O(2分)
(4)4(2分); .files/image095.gif)
.files/image096.gif) (其它合理答案也可)(2分)
(其它合理答案也可)(2分)
(5)HO-CH2-CHO(2分); HCOOCH3(2分)
37、【生物-----选修1生物技术实践】(15分)
(1)通入空气(2分) 密闭发酵罐(2分) C6H12O6???
(2)发酵过程中产生大量的CO2,及时排气可防止发酵瓶爆裂(2分)
(3)加入醋酸菌、通入空气(2分) 30-
C2H5OH+O2――CH3COOH+H2O(1分)
(4)①为果醋发酵的初期提供O2 ②为CO2的产生创造一个缓冲空间(2分)
38、【生物----选修3现代生物科技专题】(15分)
(1)人体蛋白基因与奶牛胚胎细胞中DNA(即基因) (3分)
(2)相同。因为它们都是重组细胞②经过卵裂(有丝分裂)产生的(3分)
(3)导入基因表达的产品是人血清蛋白,利用雌性奶牛可通过产奶把这种“表达物质”分泌出来(3分)
(4)核移植、胚胎分割 (3分) 胚胎移植(3分)
注意:其它解法正确的,也得分。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com