
题目列表(包括答案和解析)
| 序号 | 反应 | 平衡常数 |
| 1 | Au+6HNO3(浓)=Au(NO3)3+3NO2↑+3H2O | <<1 |
| 2 | Au3++4Cl-=AuCl4- | >>1 |

[化学—化学与技术]
粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。在实验室条件下以硫酸铜溶液为电解液,用电解的方法对粗铜提纯,并对阳极泥和电解液中金属进行回收和含量测定。回答以下问题;
(1)步骤一:电解精制:电解过程中,硫酸铜的浓度会 (选填:变大、不变、变小)。
步骤二:电解完成后,对电解液进行处理。
(2)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请写出该步反应的离子方程式: 。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
| 序号 | 反应 | 平衡常数 |
| 1 | Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O | << 1 |
| 2 | Au3+ + 4Cl— = AuCl4— | >>1 |
从中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比l:3的混合物).请你简要解释金能够溶于王水的原因 。
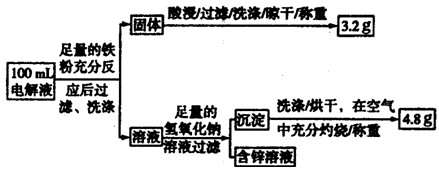
(3)电解液含量的测定:下图是该小组探究电解液的一个实验流程:

则100mL滤液中Cu2+ 的浓度为 mol·L—1 ,Fe2+的浓度为 mol·L—1
(8分)[化学—化学与技术]
粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。在实验室条件下以硫酸铜溶液为电解液,用电解的方法对粗铜提纯,并对阳极泥和电解液中金属进行回收和含量测定。回答以下问题;
(1)步骤一:电解精制:电解过程中,硫酸铜的浓度会 (选填:变大、不变、变小)。
步骤二:电解完成后,对电解液进行处理。
(2)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请写出该步反应的离子方程式: 。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
| 序号 | 反应 | 平衡常数 |
| 1 | Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O | << 1 |
| 2 | Au3+ + 4Cl— = AuCl4— | >>1 |
从中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比l:3的混合物).请你简要解释金能够溶于王水的原因 。
(3)电解液含量的测定:下图是该小组探究电解液的一个实验流程:
则100mL滤液中Cu2+的浓度为 mol·L—1 ,Fe2+的浓度为 mol·L—1
(8分)[化学—化学与技术]
粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。在实验室条件下以硫酸铜溶液为电解液,用电解的方法对粗铜提纯,并对阳极泥和电解液中金属进行回收和含量测定。回答以下问题;
(1)步骤一:电解精制:电解过程中,硫酸铜的浓度会 (选填:变大、不变、变小)。
步骤二:电解完成后,对电解液进行处理。
(2)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请写出该步反应的离子方程式: 。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
| 序号 | 反应 | 平衡常数 |
| 1 | Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O | << 1 |
| 2 | Au3+ + 4Cl— = AuCl4— | >>1 |
(8分)[化学—化学与技术]
粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。在实验室条件下以硫酸铜溶液为电解液,用电解的方法对粗铜提纯,并对阳极泥和电解液中金属进行回收和含量测定。回答以下问题;
(1)步骤一:电解精制:电解过程中,硫酸铜的浓度会 (选填:变大、不变、变小)。
步骤二:电解完成后,对电解液进行处理。
(2)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请写出该步反应的离子方程式: 。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
|
序号 |
反应 |
平衡常数 |
|
1 |
Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O |
<< 1 |
|
2 |
Au3+ + 4Cl— = AuCl4— |
>>1 |
从中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比l:3的混合物).请你简要解释金能够溶于王水的原因 。
(3)电解液含量的测定:下图是该小组探究电解液的一个实验流程:

则100mL滤液中Cu2+ 的浓度为 mol·L—1 ,Fe2+的浓度为 mol·L—1
一、选择题(本题包括18小题,每小题2分,共36分)
1
2
3
4
5
6
7
8
9
B
D
B
B
A
D
B
C
A
10
11
12
13
14
15
16
17
18
D
A
C
B
A
D
D
B
C
二、填空题(本题包括6小题,共64分)
(2)
(3) ①如2Na+2H2O = 2Na++2OH-+H2↑;
②如H++NH3×H2O = NH4++H2O;
③如Al3++3H2O Al(OH)3+3H+;
Al(OH)3+3H+;
20.(10分)(1)铼元素在自然界的存在分散,矿石中含量低,难于富集;铼元素与其他元素共存,难以分离(4分)(2)222(2分)
21.(8分)(1)吸热(2)1/9,1/7(3)2NO+O2+4CO = 4CO2+N2
22.(16分)(每空2分)(1)Al(OH)3+OH-=AlO2-+2H2O (2)
(3)①酸 ② Al3++3H2O Al(OH)3+3H+
Al(OH)3+3H+
(4)SO2+Cl2+2H2O=H2SO4+2HCl (5)HCl>H2S
(6)S2->Cl->Na+>Al3+ (7)Cl2O7(l)+H2O(l)=2HClO4(aq) △H= -4QkJ/mol
23.(12分)步骤一:(1)①正 (1分);②Cu2++2e = Cu (2分);(2)变小(1分)
步骤二:(一)①3Ag + 4H+ + NO3― = 3Ag+ + NO↑+ 2H2O(2分);
②浓盐酸含有大量氯离子,Au3+ 离子与氯离子形成稳定的AuCl4―离子,使反应2平衡向右移动,则金溶于王水中。(2分)(二)①0.5 (2分);②0.1(2分)
24.(8分)(每空2分)(1) 10Ca(OH)2+10Cl2=2Ca(C1O)2+Ca(C1O3)2+7CaCl2+10H2O
(2) 5 (3)Ⅰ < ; Ⅱ 
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com