
题目列表(包括答案和解析)
(1)实验室用二氧化锰跟浓盐酸在加热条件下反应制取氯气;高锰酸钾是常用氧化剂,用高锰酸钾跟浓盐酸反应在室温下也能制氯气,方程式为:
________KMnO4+________HCl![]() ________MnCl2+________KCl+________Cl2↑+________H2O
________MnCl2+________KCl+________Cl2↑+________H2O
先配平该方程式,再用单线桥标出该反应中电子转移的方向和数目
该反应方程式中氧化剂是________(填化学式),氧化产物是________(填化学式).作氧化剂与作还原剂的物质的量之比为________
(2)在常温下,发生下列几种反应:
①16H++10Z-+2XO![]()
![]() 2X2++5Z2+8H2O
2X2++5Z2+8H2O
②2A2++B2![]() 2A3++2B-
2A3++2B-
③2B-+Z2![]() B2+2Z-
B2+2Z-
根据上述反应,XO![]() 、Z2、B2、A3+氧化性从强到弱的顺序为:________
、Z2、B2、A3+氧化性从强到弱的顺序为:________
 实验室制取氯气方法很多,通常有如下三种:
实验室制取氯气方法很多,通常有如下三种:实验室制取氯气方法很多,通常有如下三种:
(1)用二氧化锰与浓盐酸共热制取氯气。如果将过量二氧化锰与20 mL 12 mol/L的浓盐酸混合加热,充分反应后生成的氯气明显少于0.06 mol。产生该结果的主要原因是:① ,② 。
(2)高锰酸钾与浓盐酸反应可制取氯气,其反应的化学方程式为:
。
若消耗0.1 mol氧化剂,则被氧化的还原剂的物质的量为 mol。
(3)现按如下操作进行有关氯气的制备及性质实验:在一片下衬白纸的圆形玻璃片上(如下图),A点滴一滴0.1 mol/L KI溶液(含淀粉溶液),B点滴一滴FeSO4(含KSCN)溶液,C点滴一滴NaOH(含酚酞)溶液,O点放少量KClO3晶体。向KClO3晶体滴加一滴浓盐酸,立即用表面皿盖好。试回答下列问题:
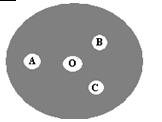
①A点反应的离子方程式为 ;
②B点的现象为 ;
③C点的溶液由红色变为无色,是因为中和褪色还是漂白而褪色,请你设计实验证明之。 。
1.B 2.B 3.B 4.D 5.D 6.C 7.B 8.D 9.C 10.B
11.B 12.D 13.A 14.C 15.D 16.D 17.B 18.C 19.C 20.A
21.(8分)(1)取少量氨水,滴加酚酞试液,溶液呈红色,然后向其中加入少量CH3COONH4晶体,振荡,可看到红色变浅,说明氨水中存在电离平衡,说明氨水是弱碱。
(2)取少量NH4Cl晶体溶于水,滴加石蕊试液,溶液呈红色,说明NH4+水解,破坏了水的电离平衡,说明氨水是弱碱。(每小题4分)
22.(12分)(1)将等质量的氯酸钾分别加入两支试管中,向其中一支试管中加人少量一定质量的二氧化锰,用酒精灯分别加热,用排水法收集产生的气体。根据收集的氧气多少,可判断反应速率。
(2)用水溶解反应后的混合物,过滤并洗涤沉淀,干燥后称量,与最初加入量比较,可证明质量是否变化。
(3)将上述不溶物与浓盐酸混合加热,检验是否有氯气生成,可证明二氧化锰化学性质是否发生变化。
(4)将收集的气体用带火星的木条检验,可证明氯酸钾含氧元素。
(5)将(2)步骤作的滤液做焰色反应,可证明氯酸钾中是否含钾元素。
(6)将(2)步操作的滤液中加入用硝酸酸化的硝酸银溶液可证明氯酸钾中是否含氯元素。
(每步2分)
 25.(12分)(1)④③⑥ (2)G接F E接J(每空3分)
25.(12分)(1)④③⑥ (2)G接F E接J(每空3分)
(3)先向试管中加入一定量的稀H2SO4,(能没过锌片),将试管倾斜,小心地将锌片贴在试管壁上,塞好胶塞,连好装置,再将试管直立,使锌与稀H2SO4反应。(3分)
(4)设收集H2 VmL(标准状况),Zn的原子量为x
H2SO4+Zn=ZnSO4+H2↑
x 22.4L
W V×10-3L
x=  (3分)
(3分)
26.(8分)(1)C F G (2分)
(2)2Fe2+ +Cl2=2Fe3++2Cl- (2分)
(3)向漏斗里注入蒸馏水,使水面没过滤渣,等水自然流完后,重复操作2~3次。(2分)
(4)继续加热,放置干燥器中冷却,称量,至最后两次称得的质量差不超过 (2分)
(2分)
 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com