Ⅰ.下列叙述正确的是
.
A.“接触法”制H
2SO
4时,催化氧化阶段的反应原理为2SO
2(g)+O
2(g)
2SO
3(g)△H<0
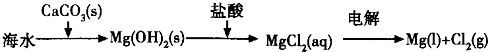
B.海水提镁的主要步骤为:
C.普通水泥的主要成分是硅酸钙
D.黏土的主要成分是三氧化二铝
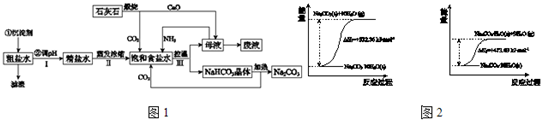
Ⅱ.工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱.请回答下列问题:
(1)路布兰法是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取、结晶而制得纯碱.
①食盐和浓硫酸反应的化学方程式为
2NaCl+H
2SO
4(浓)
Na
2SO
4+2HCl↑
2NaCl+H
2SO
4(浓)
Na
2SO
4+2HCl↑
;
②硫酸钠和焦炭、石灰石反应的化学方程式为
Na
2SO
4+2C+CaCO
3CaS+Na
2CO
3+CO
2↑
Na
2SO
4+2C+CaCO
3CaS+Na
2CO
3+CO
2↑
(已知产物之一为CaS);
(2)氨碱法的工艺如图1所示,得到的碳酸氢钠经煅烧生成纯碱.
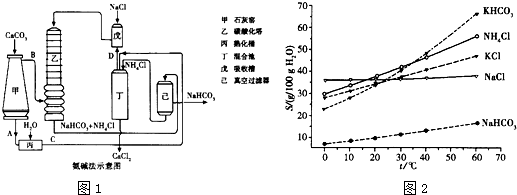
①图中的中间产物C是
Ca(OH)2
Ca(OH)2
,D是
NH3
NH3
(写化学式);
②装置乙中发生反应的化学方程式为
CO2+H2O+NH3=NaHCO3↓+NH4Cl
CO2+H2O+NH3=NaHCO3↓+NH4Cl
;
(3)联合制碱法是对氨碱法的改进,其优点是
能提高原料的利用率,减少废渣(CaCl2)的排放,保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高;
NH4Cl 可做氮肥;
可与合成氨厂联合,使合成氨的原料气 CO 转化成 CO2,革除了 CaCO3 制 CO2 这一工序
能提高原料的利用率,减少废渣(CaCl2)的排放,保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高;
NH4Cl 可做氮肥;
可与合成氨厂联合,使合成氨的原料气 CO 转化成 CO2,革除了 CaCO3 制 CO2 这一工序
;
(4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石等为原料制碳酸钾.请结合图1的溶解度(S)随温度变化曲线,分析说明是否可行?
不可行.因为KHCO3和NH4Cl的溶解度相差不大,当温度高于40℃时,KHCO3的溶解度大于NH4Cl,降温结晶时会析出较多的KCl
不可行.因为KHCO3和NH4Cl的溶解度相差不大,当温度高于40℃时,KHCO3的溶解度大于NH4Cl,降温结晶时会析出较多的KCl
.

 以下都是我们生活、学习中常见的物质,请按照要求回答相关问题:
以下都是我们生活、学习中常见的物质,请按照要求回答相关问题:
