
题目列表(包括答案和解析)
(10分)已知:a、H+(aq) + OH-(aq) = H2O(l) △H=-57.3 kJ?mol-1;
b、1.6gCH4完全燃烧生成水蒸气时放热80.2kJ,1g水蒸气转化成液态水放热2.444kJ。
(1)氢氧化钠与硫酸两稀溶液发生反应,写出表征其中和热的热化学方程式:
(2)写出表征甲烷燃烧热的热化学方程式:
(3)已知2SO2(g)+O2(g)  2SO3(g)反应过程的能量变化如图所示。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。请回答下列问题: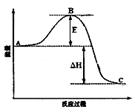
①图中C表示 E的大小对该反应的反应热有无影响? 。
②该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是 ;
(4)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=―24.8 kJ?mol-1
② 3Fe2O3(s)+ CO(g)=2Fe3O4(s)+ CO2(g) △H=―47.2 kJ?mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H= +640.5 kJ?mol-1
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
_________________________________________________。
(10分)已知:a、H+(aq) + OH-(aq) = H2O(l) △H=-57.3 kJ•mol-1;
b、1.6gCH4完全燃烧生成水蒸气时放热80.2kJ,1g水蒸气转化成液态水放热2.444kJ。
(1)氢氧化钠与硫酸两稀溶液发生反应,写出表征其中和热的热化学方程式:
(2)写出表征甲烷燃烧热的热化学方程式:
(3)已知2SO2(g)+O2(g)  2SO3(g)反应过程的能量变化如图所示。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。请回答下列问题:
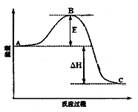
① 图中C表示 E的大小对该反应的反应热有无影响? 。
② 该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是 ;
(4)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
① Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H= ―24.8 kJ•mol-1
② 3Fe2O3(s)+ CO(g)=2Fe3O4(s)+ CO2(g) △H= ―47.2 kJ•mol-1
③ Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H= +640.5 kJ•mol-1
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
_________________________________________________。
 2SO3(g)反应过程的能量变化如图所示。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。请回答下列问题: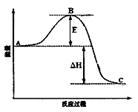
(共16分,没空2分)
已知下列热化学方程式:
①C(s)+H2O(s)===CO(g)+H2(g) ΔH=-131.3 kJ·mol-1
②H2SO4(l)+NaOH(l)===Na2SO4(l)+H2O(l) ΔH=-57.3 kJ·mol-1
③C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
④CO(g)+O2(g)===CO2(g) ΔH=-283 kJ·mol-1
⑤HNO3(aq)+NaOH(aq)===NaNO3(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
⑥H2(g)+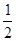 O2(g)===H2O(1) ΔH=-285.6kJ/mol
O2(g)===H2O(1) ΔH=-285.6kJ/mol
⑦C3H8(g)+5O2(g) ===3CO2(g)+4H2O(1) ΔH=-2220.0 kJ·mol-1
⑧ N2 (g)+ 3H2(g)="==" 2NH3 (g) ΔH=-92 kJ·mol-1
(1)上述热化学方程式中,不正确的有______________,不正确的理由分别是 _____________________________________________________________________________。
(2)根据上述信息,写出C转化为CO的热化学方程式:______________________。
(3)实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热6262.5kJ,则混合气体中H2和C3H8的体积比是 。
(4)已知:H2O(1)=H2O(g);ΔH=+44.0kJ/mol写出丙烷燃烧生成CO2和气态水的热化学方程式
(5)上述反应中,表示燃烧热的热化学方程式有__________________________________;
表示中和热的热化学方程式有______________。
(6) 已知H—H键能为436 kJ/mol,H—N键能为391kJ/mol,则N≡N键的键能是_____________?
(共16分,没空2分)
已知下列热化学方程式:
①C(s)+H2O(s)===CO(g)+H2(g) ΔH=-131.3 kJ·mol-1
②H2SO4(l)+NaOH(l)===Na2SO4(l)+H2O(l) ΔH=-57.3 kJ·mol-1
③C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
④CO(g)+O2(g)===CO2(g) ΔH=-283 kJ·mol-1
⑤HNO3(aq)+NaOH(aq)===NaNO3(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
⑥H2(g)+ O2(g)===H2O(1)
ΔH=-285.6kJ/mol
O2(g)===H2O(1)
ΔH=-285.6kJ/mol
⑦C3H8(g)+5O2(g) ===3CO2(g)+4H2O(1) ΔH=-2220.0 kJ·mol-1
⑧ N2 (g)+ 3H2(g) === 2NH3 (g) ΔH=-92 kJ·mol-1
(1)上述热化学方程式中,不正确的有______________,不正确的理由分别是 _____________________________________________________________________________。
(2)根据上述信息,写出C转化为CO的热化学方程式:______________________。
(3)实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热6262.5kJ,则混合气体中H2和C3H8的体积比是 。
(4)已知:H2O(1)=H2O(g);ΔH=+44.0kJ/mol写出丙烷燃烧生成CO2和气态水的热化学方程式
(5)上述反应中,表示燃烧热的热化学方程式有__________________________________;
表示中和热的热化学方程式有______________。
(6) 已知H—H键能为436 kJ/mol,H—N键能为391kJ/mol,则N≡N键的键能是_____________?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com