工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H
2(g)?CH
3OH(g)△H
(1)判断反应达到平衡状态的依据是
cd
cd
(填序号).
a. 生成CH
3OH的速率与消耗CO的速率相等
b. 混合气体的密度不变
c. 混合气体的总物质的量不变
d. CH
3OH、CO、H
2的浓度都不再发生变化
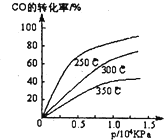
(2)CO在不同温度下的平衡转化率与压强的关系如图1

①该反应△H
<
<
0(填“>”或“<”).
②实际生产条件控制在250℃、1.3×10
4 kPa左右,选择此压强的理由是
在1.3×104Kpa下,CO转化率已较高,再增大压强CO转化率提高不大,而生产成本增加,得不偿失
在1.3×104Kpa下,CO转化率已较高,再增大压强CO转化率提高不大,而生产成本增加,得不偿失
.
(3)右图2表示在温度分别为T
1、T
2时,平衡体系中H
2的体积分数随压强变化曲线,A、C两点的反应速率A
<
<
C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A
=
=
C,由状态B到状态A,可采用
升温
升温
的方法(填“升温”或“降温”).
(4)一定条件下,0.5mol甲醇蒸气完全燃烧生成二氧化碳气体和液态水,放出Q KJ的热量.写出该反应的热化学方程式
2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l)△H=-4Q kJ/mol
2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l)△H=-4Q kJ/mol
.
(5)图3是甲醇燃料电池(电解质溶液为KOH溶液)结构示意图,写出 a处电极上发生的电极反应式
CH3OH-6e-+8OH-=CO32-+6H2O
CH3OH-6e-+8OH-=CO32-+6H2O
.



 工业上一般在密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)?CH30H(g)
工业上一般在密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)?CH30H(g) (2011?山东)研究NO2、SO2、CO等大气污染气体的处理有重要意义.
(2011?山东)研究NO2、SO2、CO等大气污染气体的处理有重要意义.