
题目列表(包括答案和解析)
 A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物.回答下列问题:
A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物.回答下列问题:0.5L 1 mol 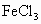 溶液与0.2L 2.5mol/L KCl溶液中
溶液与0.2L 2.5mol/L KCl溶液中 的物质的量浓度之比为
的物质的量浓度之比为
[ ]
0.5L 1 mol  溶液与0.2L 2.5mol/L KCl溶液中
溶液与0.2L 2.5mol/L KCl溶液中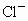 的物质的量浓度之比为
的物质的量浓度之比为
[ ]
25℃时,将1 mol NH4NO3溶于水,向该溶液滴加b L氨水后溶液呈中性,据此判断下列说法中不正确的是(NH3·H2O的电离平衡常数取Kb=2×10-5mol·L-1)
A.滴加氨水的过程中,水的电离平衡将正向移动
B.滴加b L氨水后的溶液中,n(NH4+) = 200 n(NH3·H2O) = 1 mol
C.所滴加氨水的浓度为0.005 / b mol·L-1
D.滴加b L氨水后的溶液中各离子浓度大小是:c(NH4+) = c(NO3-) > c(H+) = c(OH-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com