
题目列表(包括答案和解析)
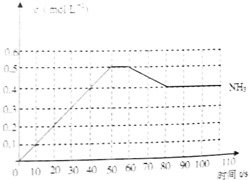 哈伯因发明了氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖,N2(g)+3H2(g)
哈伯因发明了氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖,N2(g)+3H2(g)| 催化 |
| 0.52 |
| 2.253×0.75 |
| 0.52 |
| 2.253×0.75 |

哈伯因发明了氮气和氢气合成氨气的方法而获得1918年的诺贝尔化学奖,
N2(g)+3H2(g)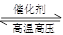 2NH3(g) △H<0。下图表示某温度时,向1L容器中加入1mol氮气,3mol氢气,该反应在110S内反应进行的程度:
2NH3(g) △H<0。下图表示某温度时,向1L容器中加入1mol氮气,3mol氢气,该反应在110S内反应进行的程度:

(1)此反应在50~60s时化学平衡常数为K1 = (列出计算式不用试算)。
(2)反应进行到60s时,改变的条件可能是 。
A.加入催化剂 B.扩大容器的体积
C.升高温度 D.减小氨气的浓度
在该条件下,氮气的化学反应速率 。(填“变小”、“变大”或“不变”)
(3)该反应在80s后化学平衡常数为K2,则K1 K2(填“>”、“<”或“=”),此时氮气的转化率为 。
(4)若在110s后向该平衡体系中再加入1mol氨气,则再次达平衡后,氨气在平衡体系中的体积分数 。(填“变小”、“变大”或“不变”)
哈伯因发明了氮气和氢气合成氨气的方法而获得1918年的诺贝尔化学奖,
N2(g)+3H2(g)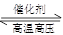 2NH3(g) △H<0。下图表示某温度时,向1L容器中加入1mol氮气,3mol氢气,该反应在110S内反应进行的程度:
2NH3(g) △H<0。下图表示某温度时,向1L容器中加入1mol氮气,3mol氢气,该反应在110S内反应进行的程度: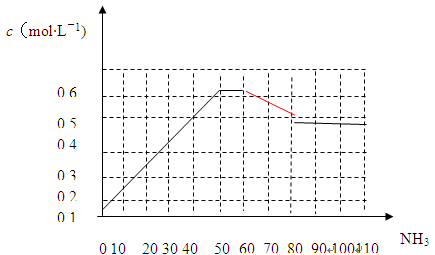
(1)此反应在50~60s时化学平衡常数为K1 = (列出计算式不用试算)。
(2)反应进行到60s时,改变的条件可能是 。
| A.加入催化剂 | B.扩大容器的体积 |
| C.升高温度 | D.减小氨气的浓度 |
在1000K时,已知反应Ni(s)+H2O(g)![]() NiO(s)+H2(g)的平衡常数K=0.0059。当水蒸气和氢气的物质的量浓度相等时,此反应是否已达平衡状态( )
NiO(s)+H2(g)的平衡常数K=0.0059。当水蒸气和氢气的物质的量浓度相等时,此反应是否已达平衡状态( )
A.已是平衡状态 B.未达平衡状态,反应正向进行
C.未达平衡状态,反应逆向进行 D.无法确定
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com