
题目列表(包括答案和解析)
 (1)通过分析上表数据,你可得出影响化学反应速率的因素及相关结果的结论是:
(1)通过分析上表数据,你可得出影响化学反应速率的因素及相关结果的结论是:
①
②
③
过氧化氢的浓度
㈠㈠①
(2)由上述实验可知,实验室用过氧化氢制取氧气的最合适的条件是 。
(3)实验室需配制450克5%的过氧化氢溶液,其操作为:往一定量30%的过氧化氢溶液中加入
|
(08年厦门市适应性考试)
为测定过氧化氢溶液的浓度,小明将一定量的过氧化氢溶液加入如图1的锥形瓶中,再加入少量二氧化锰,待反应完成后,称量锥形瓶和剩余物质的总质量。

(图1) (图2) (图3)
小明进行了四次实验,结果如下表:
序号 | 锥形瓶质量(g) | 过氧化氢溶液体积(mL) | 二氧化锰质量(g) | 反应完成后锥形瓶和剩余物质总质量(g) |
1 | 80.0 | 100.0 | 1.6 | 180.2 |
2 | 80.0 | 100.0 | 1.6 | 179.8 |
3 | 80.0 | 100.0 | 1.6 | 180.0 |
4 | 80.0 | 100.0 | 1.6 | 182.6 |
请回答下列问题:(假设过氧化氢溶液的密度为1 g •cm-3,实验在标准状况下进行)
(1)写出上述反应的化学方程式 ;
(2)若以上表中的数据计算,该过氧化氢溶液的物质的量浓度是 ;
(3)若用图2装置代替图1中的锥形瓶进行实验,结果将更准确,其理由是 ;
(4)若用图3装置代替图2进行实验,结果将更加准确,其理由是 ;
(5)若过氧化氢溶液的浓度约为1mol •L-1,取20.0 mL该溶液按图3方案进行实验,则该实验应选用的量筒规格是 ( );
A.1000 mL B. 500 mL C. 250 mL D. 100 mL
(6)有人认为上述三个方案均不够好,可以采用滴定的方法进行测定,其反应原理为:
2KMnO4+5H2O2+3H2SO4==K2SO4+2MnSO4+5O2↑+8H2O
若过氧化氢溶液的浓度约为1mol •L-1,取10.0 mL,用0.5000 mol•L-1酸化的高锰酸钾溶液进行滴定。则:
①滴定时,盛装高锰酸钾溶液应选用 (填“酸式”或“碱式”)滴定管;
②判断到达滴定终点的现象是 ;
③实验时,需要记录的数据有 ;
④消耗的酸化高锰酸钾溶液的体积约为 mL。
“卤块”的主要成分为MgCl2(含Fe2+、Fe3+、Mn2+等杂质离子),若以它为原料,按如下工艺流程图,即可制得“轻质氧化镁”。如果要求产品尽量不含杂质离子,而且成本较低,流程中所用试剂或PH值控制可参考下列附表确定

轻质氧化镁生产工艺流程图
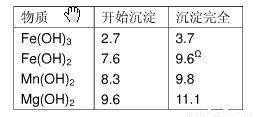
表1 生成氢氧化物沉淀的PH值
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 Fe(OH)2 Mn(OH)2 Mg(OH)2 | 2.7 7.6 8.3 9.6 | 3.7 9.6 9.8 11.1 |
*)注:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常常将它氧化成为Fe3+,生成
Fe(OH)3沉淀而去除之。
表2 化学试剂价值表
| 试剂 | 价格(元/t) |
| 漂液(含NaClO25.2%) H2O2(30%) NaOH(固98%) Na2CO3(固99.5%) 卤块(MgCl2,30%) | 450 2400 2100 600 310 |
请填写以下空白:
(1)在步骤②加入的试剂X,最佳选择应是 ,其作用是 。
(2)步骤③加入的试剂Y应是 ;之所以要控制pH=9.8,其目的是 。
(3)在步骤⑤时发生的化学反应方程式是:
“卤块”的主要成分为MgCl2(含Fe2+、Fe3+、Mn2+等杂质离子),若以它为原料,按如下工艺流程图,即可制得“轻质氧化镁”。如果要求产品尽量不含杂质离子,而且成本较低,流程中所用试剂或pH值控制可参考下列附表确定。轻质氧化镁工艺流程图如下:
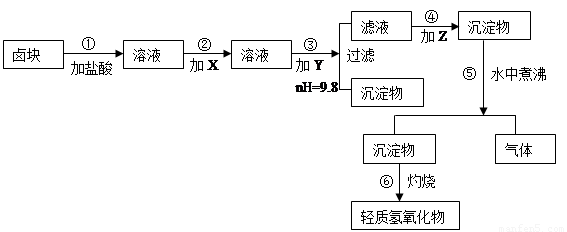
表1 化学试剂价格表
|
试剂 |
价格(元/ t ) |
|
漂液(含NaClO25.2%) H2O2(30%) NaOH(固98%) Na2CO3(固99.5%) 卤块(MgCl2,30%) |
450 2400 2100 600 310 |
表2 生成氢氧化物沉淀的值
|
物质 |
开始沉淀 |
沉淀完全 |
|
Fe(OH)3 Fe(OH)2 Mn(OH)2 Mg(OH)2 |
2.7 7.6 8.3 9. |
3.7 9.6Ω 9.8 11.1 |
Ω注:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常将它氧化成为Fe3+,生成Fe(OH)3沉淀而去除之。请填写以下空白:
⑴、在步骤②加入试剂X,最佳选择应是 ,其作用是 。
⑵、在步骤③加入的试剂Y应是 ,之所以要控制pH=9.8,其目的
是 。
⑶、在步骤⑤时发生的化学反应方程式是: 。

题号
1
2
3
4
5
6
7
8
答案
C
C
A
B
C
D
B
A
题号
9
10
11
12
13
14
15
16
答案
B
B
C
D
B
A
C
D

|