
题目列表(包括答案和解析)
某研究性学习小组欲测定某绿色粉末Cu2(OH)2CO3?xH2O中的x值,并进行相关实验探究。
已知:Cu2(OH)2CO3?xH2O固体在加热条件下发生反应:
Cu2(OH)2CO3?xH2O![]() 2CuO+CO2↑+(x+1)H2O
2CuO+CO2↑+(x+1)H2O
(Mr[Cu2(OH)2CO3])=222; Mr(CuO)=80; Mr(CO2)=44; Mr(H2O)=18)
[实验一]测定Cu2(OH)2CO3?xH2O中的x值
(1)准确称取m![]() g。该粉末样品,置于批涡中,用酒精灯缓慢加热至完全分解,冷却,称得剩余固体的质量为m
g。该粉末样品,置于批涡中,用酒精灯缓慢加热至完全分解,冷却,称得剩余固体的质量为m![]() g。加热粉末时,除了坩祸、坩锅钳、三角架、玻璃棒、酒精灯外还要用到的仪器是 ,操作中需要用玻璃棒轻轻搅拌固体,目的是
g。加热粉末时,除了坩祸、坩锅钳、三角架、玻璃棒、酒精灯外还要用到的仪器是 ,操作中需要用玻璃棒轻轻搅拌固体,目的是
所测得的x值为_ (用含m![]() 、m
、m![]() 的代数式表示)。
的代数式表示)。
(2)下列是甲、乙两位同学对实验过程中绿色粉末是否已完全分解的判断依据。
甲:观察到粉末变成黑色,不再有水蒸气逸出。
乙:重复加热、冷却、称量,至恒重(两次称量的质量差不超过0.1g)。
你认为其中合理的是 (填“甲”或“乙”)。
(3)测定x值还有其它方法。下列是几位同学在实验设计中拟测定的数据,其中无法计算得出x值的是 (填序号)。
①只测定生成物CO2、CuO的质量
②只测定生成物CO2、H2O的质量
③只测定反应物Cu2(OH)2CO3?xH2O和生成物CO2的质量
④只测定反应物Cu2(OH)2CO3?xH2O和生成物H2O的质量
「实验二」利用上述反应的分解产物氧化铜氧化乙醇制备乙醛(沸点为20.8℃)。
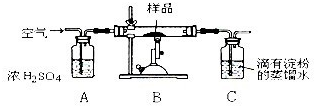
(1)用如图所示装置(图中夹持装置已略去)进行实验时,需要加热的仪器是 (填标号)。B装置中收集到的物质有 。

(2)能证明氧化铜氧化乙醇的实验现象是
试管A内发生反应的化学方程式为 。
| 高温 |
| 高温 |
 某课外活动小组欲利用下列装置(部分固定装置略)完成下列实验;
某课外活动小组欲利用下列装置(部分固定装置略)完成下列实验;| 步骤 | 实验过程 | 实验现象 | 有关化学方程式 |
| 1 | / | / | |
| 2 | 在C中加入样品W克,D中装入碱石 灰后并称量为m1克.连接好仪器,打开A的活塞,慢慢加溶液. |
||
| 3 | 对C进行加热.当C中药品充分反应后.关闭A的活塞.停止加热: | ||
| 4 | 冷却后,称量D的质量为m2克. | / | / |
W-
| ||
| W |
W-
| ||
| W |

(16分)某课外活动小组欲利用下列装置(部分固定装置略)完成下列实验;
(一)实验目的:测定铜粉(含炭)样品中铜的质量分数
(二)实验用品:仪器:天平、分液漏斗、锥形瓶、硬玻璃管、干燥管、酒精灯、洗气瓶药品:红褐色铜粉(含炭)样品、过氧化氢溶液、二氧化锰、碱石灰。浓硫酸等
(三)实验内容:
在答题卡上按完成下表空白处内容
| 步骤 | 实验过程 | 实验现象 | 有关化学方程式 |
| 1 |
|
| .com |
| 2 | 在C中加入样品W克,D中装入碱石 灰后并称量为m1克。连接好仪器,打开A的活塞,慢慢加溶液。 |
|
|
| 3 | 对C进行加热。当C中药品充分反应后。关闭A的活塞。停止加热: |
|
|
| 4 | 冷却后,称量D的质量为m2克。 |
|
|
(四)计算:样品中铜的质量分数=______________(用含W、m1.m2的代数式表示)
(五)问题和讨论:
该小组重复测定了三次,得到铜的质量分数的数据存在较大的偏差,你认为原因可能是 。
A.装置内原有空气中的二氧化碳气体也被碱石灰吸收
B.装置B中的产生的气体中的水蒸气通过C被D中碱石灰吸收
C.反应完成后,装置中的二氧化碳没有全部被碱石灰吸收
题号
1
2
3
4
5
6
7
8
答案
C
C
A
B
C
D
B
A
题号
9
10
11
12
13
14
15
16
答案
B
B
C
D
B
A
C
D

|