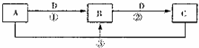
A、B、C、D、E为中学化学常见的单质或化合物,它们之间的相互转化关系如图所示(部分产物略去).

请回答下列问题:
(1)若A是能使湿润的红色石蕊试纸变蓝的气体,C、D均为空气的主要成分,E是一种有毒气体.
①C分子的电子式为
:
②写出反应I的化学方程式:
;
③写出反应Ⅱ的化学方程式:
.
(2)若A是淡黄色固体化合物;常温下D是无色气体;C分子中含有的阴、阳离子均为10电子粒子.
①D的结构式为
O=C=O
O=C=O
,C分子中所含化学键的类型是
离子键和共价键
离子键和共价键
;
②写出反应I的化学方程式:
2Na2O2+2CO2=2Na2CO3+O2
2Na2O2+2CO2=2Na2CO3+O2
;
③写出反应Ⅱ的化学方程式:
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
(3)将(2)中一定量的气体D通入2L含C的溶液中,在反应后所得的溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发).

①O点溶液中所含溶质的化学式为
NaHCO3、NaOH
NaHCO3、NaOH
,常温下a点溶液的pH
>
>
7(填“>”、“=”或“<”),a点溶液中各离子浓度由大到小的关系是
c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
;
②标准状况下,通入气体D的体积为
44.8
44.8
L,C溶液的物质的量浓度为
2.5
2.5
mol?L
-1.





 (2011?山西模拟)A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件未标出),其中反应①是置换反应.
(2011?山西模拟)A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件未标出),其中反应①是置换反应.

 Ⅰ
Ⅰ A、B、C、D、E、F六神物质的相互转化关系如下图所示(反应条件末标出),其中反应①是置换反应.
A、B、C、D、E、F六神物质的相互转化关系如下图所示(反应条件末标出),其中反应①是置换反应.

 A、B、C、D、E为中学化学常见的单质或化合物,相互转化关系如图所示.
A、B、C、D、E为中学化学常见的单质或化合物,相互转化关系如图所示.