
题目列表(包括答案和解析)
现有常温时pH=1的某强酸溶液10mL,下列操作能使溶液的pH变成2的是( )
A.加入10mL 0.01mol?L-1的NaOH溶液
B.加入10mL 的水进行稀释
C.加水稀释成100mL
D.加入10mL 0.01mol?L-1的盐酸溶液
现有常温时pH=1的某强酸溶液10mL,下列操作能使溶液的pH变成2的是( )
A.加入10mL 0.01mol?L-1的NaOH溶液 B.加入10mL 的水进行稀释
C.加水稀释成100mL D.加入10mL 0.01mol?L-1的盐酸溶液
(08浙江淳安县三校联考)常温时,以下4种溶液PH最小的是 ( )
A.0.01mol ?L-1醋酸溶液
B.0.02mol ?L-1醋酸与0.02mol ?L-1NaOH溶液等体积混合液
C.0.03mol ?L-1醋酸与0.01mol ?L-1NaOH溶液等体积混合液
D.PH = 2的盐酸与PH = 12的NaOH溶液等体积混合液
 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。 式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。 中性,则Va︰Vb= 。
中性,则Va︰Vb= 。

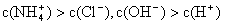

 NH3·H2O + H+,则该反应常温下的平衡常数K= (已知:常温下,NH3·H2O的电离平衡常数Kb=1.7×10—5 mol·L—1)
NH3·H2O + H+,则该反应常温下的平衡常数K= (已知:常温下,NH3·H2O的电离平衡常数Kb=1.7×10—5 mol·L—1)湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com