
题目列表(包括答案和解析)
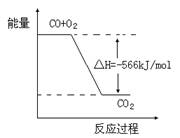
已知:2CO(g)+O2(g)=2CO2(g);ΔH=-566 kJ/mol Na2O2(s)+CO2(g)=Na2CO3(s)+1/2O2(g);ΔH=-226 kJ/mol根据以上热化学方程式判断,下列说法正确的是
Na2O2(s)+CO2(g)=Na2CO3(s)+1/2O2(g);ΔH=-226 kJ/mol根据以上热化学方程式判断,下列说法正确的是
 A.CO的燃烧热为283 kJ
A.CO的燃烧热为283 kJ
B.右图可表示由CO生成CO2的反应过程和能量关系
 C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g);ΔH>-452 kJ/mol
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g);ΔH>-452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
2CO(g)+SO2(g) 2CO2(g)+S(l)
△H
2CO2(g)+S(l)
△H
(1)已知2CO(g)+O2(g)= 2CO2(g) △H1=—566kJ•mol—1
S(l) +O2(g)= SO2(g) △H2=—296kJ•mol—1
则反应热ΔH= kJ•mol-1。
(2)其他条件相同、催化剂不同时,SO2的转化率随反应温度的变化如图a。260℃时 (填Fe2O3、NiO或Cr2O3)作催化剂反应速率最快。Fe2O3和NiO作催化剂均能使SO2的转化率达到最高,不考虑价格因素,选择Fe2O3的主要优点是 。

(3)科研小组在380℃、Fe2O3作催化剂时,研究了不同投料比[n(CO)∶n(SO2)]对 SO2转化率的影响,结果如图b。请在答题卡坐标图中画出n(CO)∶n(SO2)=2∶1 时,SO2转化率的预期变化曲线。
(4)工业上还可用Na2SO3溶液吸收烟气中的SO2:Na2SO3+SO2+H2O=2NaHSO3。某温度下用1.0mol•L-1 Na2SO3溶液吸收纯净的SO2,当溶液中c(SO32-)降至 0.2mol•L-1时,吸收能力显著下降,应更换吸收剂。
①此时溶液中c(HSO3-)约为______mol•L-1;
②此时溶液pH=______。(已知该温度下SO32—+H+ HSO3—的平衡常数K=8.0 × 106 L•mol-1,计算时SO2、H2SO3的浓度忽略不计)
HSO3—的平衡常数K=8.0 × 106 L•mol-1,计算时SO2、H2SO3的浓度忽略不计)
NA代表阿伏加德罗常数,下列说法正确的是:( )
A.分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g
B.已知2CO(g)+O2(g)
 2CO2(g);△H=-akJ﹒mol-1 将2NA个CO与NA个O2混合充分反应放出akJ的热量。
2CO2(g);△H=-akJ﹒mol-1 将2NA个CO与NA个O2混合充分反应放出akJ的热量。
C.用石灰乳完全吸收l mol Cl2时,转移电子的数目是NA
D.常温下,0.1mol/LNa2CO3溶液中,含有阴离子的总数大于0.1NA
A.-283.0 kJ·mol-1 B.-566.0 kJ·mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com