
题目列表(包括答案和解析)
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=+49.9kJ?mol―1
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g);△H=-192.9kJ?mol―1
O2(g)=CO2(g)+2H2(g);△H=-192.9kJ?mol―1
下列说法正确的是( )
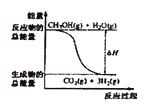
A.CH3OH的燃烧热为192.9 kJ?mol―1
B.反应①中的能量变化如上图变化
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:CH3OH(l)+1/2 O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ?mol―1
下列热化学方程式正确的是(△H的绝对值均正确)
A.2NO2![]() N2O4 △H= -57kJ/mol(反应热)
N2O4 △H= -57kJ/mol(反应热)
B.1/2Ba(OH)2(aq)+HCl(aq)==1/2BaCl2(aq)+H2O(l)△H= -57.3kJ/mol(中和热)
C.S(s)+O2(g)==SO2(g) △H= + 269.8kJ/mol(反应热)
D. C8H18(l)+1/2 O2(g) ==8CO2(g)+9H2O(g) ΔH= - 5518kJ·mol-1(燃烧热)
已知:原电池H2(g)| NaOH(aq) | HgO(s),Hg(l) 在298.15K下的标准电动势Ey=0.926V
反应H2(g) + 1/2 O2(g) = H2O(l) rGmy(298K) = 237.2kJ?mol1
物 质 | Hg(l) | HgO(s) | O2(g) |
Smy(298K)/J?mol1?K1 | 77.1 | 73.2 | 205.0 |
2-1写出上述原电池的电池反应与电极反应(半反应)。
2-2计算反应HgO(s)=Hg(l) + ½ O2(g) 在298.15K下的平衡分压p(O2)和rHmy(298.15K)。
2-3设反应的焓变与熵变不随温度而变,求HgO固体在空气中的分解温度。
(14分)工业常利用CO来制氢气。已知在25℃时:
C(s,石墨) + 1/2 O2(g) = CO(g) △H1= -111kJ/mol
H2(g) + 1/2 O2(g) = H2O(g) △H2= -242kJ/mol
C(s,石墨) + O2(g) = CO2(g) △H3= -394kJ/mol
(1)在25℃时,CO(g)
+ H2O(g)  CO2(g) + H2(g) △H=_____________。
CO2(g) + H2(g) △H=_____________。
(2)在2L密闭容器中,将2
mol CO与3 mol H2O混合加热到800℃,发生下列反应:CO(g)+H2O(g)  CO2(g)+H2(g) K=1.0。则平衡后CO的转化率为_______,平衡混合物中H2的体积分数为_______。
CO2(g)+H2(g) K=1.0。则平衡后CO的转化率为_______,平衡混合物中H2的体积分数为_______。
(3)将(2)中的平衡后的混合气体通入300mL 6mol/L NaOH溶液中,充分吸收,所得溶液中离子浓度由大到小的顺序为_________________________________________________。
(4)将(3)中剩余的气体通过足量浓硫酸后,再与足量氧气用电火花引燃后通入足量的过氧化钠中,过氧化钠的质量增重______g。
(5)工业上也可以用CO和H2生产甲醇:CO(g) + 2H2 (g) = CH3OH (g),在一定条件下,该反应在一个密闭容器中达到平衡,若维持c(H2)和容器的温度不变,增大容器的体积,则平衡_________(填字母)
A.不移动 B.向正反应方向移动
C.向逆反应方向移动 D.无法判断移动的方向
已知在25℃、1.0×105Pa条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
A.H2O(g)==H2(g)+1/2 O2(g) ΔH=+242 kJ·mol-1
B.2H2(g)+O2(g)===2H2O(l) ΔH=-484 kJ·mol-1
C.H2(g)+1/2 O2(g)==H2O(g) ΔH=+242 kJ·mol-1
D.2H2(g)+O2(g)==2H2O(g) ΔH=+484 kJ·mol-1
一、二选择题答案
1
2
3
4
5
6
B
D
D
A
C
C
7
8
9
10
11
12
A
C
D
C
D
C
13
14
15
16
17
18
B
C
D
A
D
D
19
20
21
22
23
D
B
C
B
A
三、
24、(7分)
(1) H : O : H (1分)
(2分)3NO2+H2O=2HNO3+NO
Cl2+H2O=HCl+HClO
2Na2O2+2H2O=4NaOH+O2↑
25、(6分)
(1) C 氧原子结构示意图 (每空1分)
 (2)
Al2(SO4)3 (1分) Al3+ +
3H2O
Al(OH)3 +3 H+ (2分) 硫酸或亚硫酸或碳酸(1分)(写出一种即可,合理答案也可)
(2)
Al2(SO4)3 (1分) Al3+ +
3H2O
Al(OH)3 +3 H+ (2分) 硫酸或亚硫酸或碳酸(1分)(写出一种即可,合理答案也可)
26、(8分)
(1)假设2:溶液中存在HCO3-
假设3:溶液中存在CO32-和HCO3-
假设4:溶液中存在CO32-和SO42-
假设5:溶液中存在SO42 、HCO3- (顺序不限。)(各1分)
(2)①用胶头滴管取少量溶液加入试管中,再用滴管取过量的1mol/L氯化钡溶液并滴加到试管A中,充分反应后,静置,然后过滤,将沉淀和滤液分别装入另外的两个试管中(2分);产生白色沉淀。
②往装有沉淀的试管中加入过量的2mol/L盐酸;沉淀部分溶解且有气体生成。说明原溶液中一定含有SO42-和CO32-。
③往装有滤液的试管中加入2mol/L盐酸;出现无色气体,说明原溶液中含有HCO3-。
((每空各1分。其他合理方案参照给分)
27、(13分)(1)不能 (1分) 温度高,水为气态,不利于氨气的生成 (2分)
(2) 25% (2分)K= (1分) 减小 减小 (2分)
(3) C3H3N6 (2分)6CO(NH2)2=6NH3+3CO2+C3H6N6 (2分)
N C N H H (1分)
28、(10分)
(1) 第四周期,第Ⅷ族 (2分)
(2) 3Fe3O4+8Al=9Fe+4Al2O3 (2分) 由来冶炼难熔金属(其他正确答案参照给分)(1分)
Al2O3+2OH-=2AlO2-+H2O (2分)
(3) Cl2+2Fe2+=2Fe3++2Cl- (1分) 3SCN-+Fe3+=Fe(SCN)3 (2分)
29、(15分)
⑴①阳离子交换膜 (2分) ② 2Cu2++4e-=2Cu 4OH-―4e-=2H2O+O2 (各1分)
(2)Cl2+2Br-=Br2+2Cl- (2分) BrO3- 5Br- (各1分)
分液漏斗 烧杯(各1分) ② (1分)
(3)H2S+HDO=HDS+H2O ③H2S(每空2分,共10分)
30、(15分)
(1)B (1分) 第4周期第IB族 (各1分) 1s22s22P63s23P63d104s1或[Ar] 3d104s1 (2分) (2) CO2 、CCl4 (其他合理答案参照给分)(各1分) 分子晶体 原子晶体 (各1分) (3) 7 1 (各1分) (4) IIIA IVA ; b (各1分)
A点所示的氢化物是水,其沸点在氧族元素的氢化物中最高是由于在水分子间存在着氢键,其强度远大于分子间作用力。(1分)
31、(15分)略
(1) (各1分)
(2) (各1分)
(3) (各2分)
(4) 3 3:2:2 (各1分)
(5) (各1分)

 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
www.ks5u.com
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com