
题目列表(包括答案和解析)
物质在水溶液中存在的电离平衡、水解平衡和沉淀溶解平衡,都可看作化学平衡。请根据所学知识回答:
(1)在0.1mo1?L-1的NaHSO3溶液中存在的各种平衡体系为(用离子方程式表示)_______.
已知该溶液中有关微粒浓度由大到小的顺序为:c(Na+)>c(HSO![]() )>c(SO
)>c(SO![]() )>c(H2SO4)。则该溶液中c(H+) c(OH-) (填“大于”、“小于”或“等于”),简述理由:__________________________________________.
)>c(H2SO4)。则该溶液中c(H+) c(OH-) (填“大于”、“小于”或“等于”),简述理由:__________________________________________.
(2)常温下,某水溶液中存在的离子有:Na+、A―、H+、OH―,若该溶液由0.1mo1.L-1的HA溶液和0.1mol.L-1的NaOH溶液等体积混合而得,则溶液的pH _________(填“大于”、“小于”或“等于”)7,理由是____________。
(3)25℃时,Fe(OH)3的KSP=1.0×10-38mol4?L-4,Mg(OH)2的KSP=1.0×10-11mol3?L-3。某混合溶液中Fe3+和Mg2+的浓度均为1.0 ![]() 10-2mo1.L―1,现要除去溶液中的Fe3+,而Mg2+不沉淀,应将溶液的pH控制在________范围之内。(化学上通常认为残留在溶液中的离子浓度小于1.0×10-5mol.L-1时,沉淀就达到完全)
10-2mo1.L―1,现要除去溶液中的Fe3+,而Mg2+不沉淀,应将溶液的pH控制在________范围之内。(化学上通常认为残留在溶液中的离子浓度小于1.0×10-5mol.L-1时,沉淀就达到完全)


| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
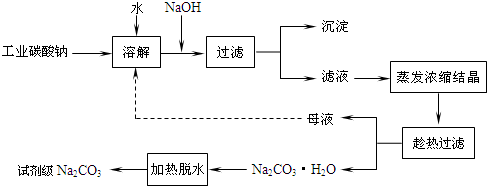
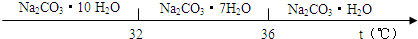
以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁的主要流程如下:
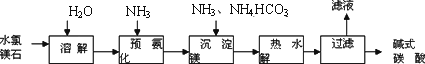
(1)预氨化过程中有Mg(OH)2沉淀生成,已知常温下Mg(OH)2的Ksp=1.8×10-11,若溶液中c(OH-)=3.0×10-6 mol·L-1,则溶液中c(Mg2+)=________.
(2)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为________.
(3)高温煅烧碱式碳酸镁得到MgO.取碱式碳酸镁4.66 g,高温煅烧至恒重,得到固体2.00 g和标准状况下CO2 0.896 L,通过计算确定碱式碳酸镁的化学式.
(4)若热水解不完全,所得碱式碳酸镁中将混有MgCO3,则产品中镁的质量分数________(填“升高”、“降低”或“不变”).
一、单项选择题(本题包括8小题,每题3分,共24分。)
1.D 2.B 3.A 4.D 5.B 6.C 7.C 8.A
二、不定项选择题(本题包括6小题,每小题4分,共24分。)
9.AD 10.B 11.BC 12.AD 13.CD 14.C
三、非选择题(本题包括6小题,共60分)
15.(10分)
【提出猜想】 SO2、H2
【实验探究】
猜想Ⅰ
步骤① 溶液紫红色褪去 含有Fe2+
步骤② 另取少量所得溶液,滴加KI和淀粉溶液 溶液变为蓝色
猜想Ⅱ
甲中KMnO4溶液褪色,乙中KMnO4溶液颜色不变,试管中收集到气体
【问题讨论】
不正确。若溶液中含有Fe3+则无法检验溶液中是否含有Fe2+
16.(8分)
 ⑴ HNO3
⑴ HNO3
⑵ 3CuO+2NH3 3Cu+N2+3H2O
⑶ 2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42-

⑷ 6NO+4NH3 5N2+6H2O
17.(10分)
(1)0.3 mol/(L?min) 升高温度
(2)

(3)-41.2 kJ/mol a
18.(10分)
⑴ 熵变大于零(△S>0) 隔绝空气
⑵ 10 TiO2++2H2O=TiO(OH)2↓+2H+
⑶ d
19.(12分)
(1)4
(2) 还原反应
还原反应
(3) 、
、
(4)
20.(10分)

⑴ ①
② 解:(C6H10O5)n~n C6H12O6~2nC2H5OH~nCH3COOC2H5
162n 88n
m(CH3COOC2H5)=374 kg
⑵ 解:[(C6H7O2)(OH)3]n~[(C6H7O2)(OH)(3-x)(OOCCH3)x]n △m
162n 162n+42nx 42nx
 =
= x=2
x=2
故该醋酸纤维的结构简式为[(C6H7O2)(OH)(OOCCH3)2]n
四、选做题(本题包括1小题,共12分)
21.(12分)
A.⑴ O>N>C 1s22s22p63s23p63d84s2
⑵ 顺铂易溶于水,因为它是极性分子,易溶于极性溶剂
⑶ 4
⑷ ① ② sp3和sp2
② sp3和sp2
B.⑴ 玻璃棒、胶头滴管 煮沸除去CO2并迅速冷却
⑵ 酚酞 滴定产物CH3COONa溶液呈碱性,应选择在碱性范围中变色的指示剂
⑶ 用活性炭脱色
⑷ 4.50
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com