
题目列表(包括答案和解析)

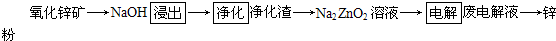
现代炼锌的方法可分为火法(蒸馏法)和湿法(电解法)两大类。
Ⅰ. 火法炼锌工艺如下:

焙烧和蒸馏过程中发生的主要反应有:
2ZnS(s)+3O2(g)===2ZnO(s)+2SO2(g) ΔH1=a kJ·mol-1 ①
2C(s)+O2(g)===2CO(g) ΔH2=b kJ·mol-1 ②
ZnO(s)+CO(g)===Zn(g)+CO2(g) ΔH3=c kJ·mol-1 ③
(1) 以上三个反应中,一定是放热反应的是______________(填序号)。
(2) 反应:ZnS(s)+C(s)+2O2(g)===Zn(g)+SO2(g)+CO2(g) ΔH=____________kJ·mol-1。
Ⅱ. 湿法炼锌工艺如下:
(3) 写出“浸出”主要反应的离子方程式:__________________________。
(4) “电解”获得锌的电极反应为______________________。
(5) 该工艺中可循环利用的物质是______________________________(填化学式)。
现代炼锌的方法可分为火法(蒸馏法)和湿法(电解法)两大类。
Ⅰ. 火法炼锌工艺如下:
焙烧和蒸馏过程中发生的主要反应有:
2ZnS(s)+3O2(g)===2ZnO(s)+2SO2(g) ΔH1=a kJ·mol-1 ①
2C(s)+O2(g)===2CO(g) ΔH2=b kJ·mol-1 ②
ZnO(s)+CO(g)===Zn(g)+CO2(g) ΔH3=ckJ·mol-1 ③
(1) 以上三个反应中,一定是放热反应的是______________(填序号)。
(2) 反应:ZnS(s)+C(s)+2O2(g)===Zn(g)+SO2(g)+CO2(g) ΔH=____________kJ·mol-1。
Ⅱ. 湿法炼锌工艺如下:
(3) 写出“浸出”主要反应的离子方程式:__________________________。
(4) “电解”获得锌的电极反应为______________________。
(5) 该工艺中可循环利用的物质是______________________________(填化学式)。
 2ZnO+ 2SO2;鼓风炉中:2C+O2
2ZnO+ 2SO2;鼓风炉中:2C+O2 2CO、ZnO+CO
2CO、ZnO+CO Zn+CO2。用火法炼锌蒸馏后的残渣中含多种金属单质及In2O3,可用硫酸提取铟,某研究机构对此研究的数据如下。实验中涉及的酸度(每升溶液中含硫酸的质量)与铟的浸出率的关系如图甲;硫酸溶液的体积与固体的体积比对铟浸出率的影响如图乙。
Zn+CO2。用火法炼锌蒸馏后的残渣中含多种金属单质及In2O3,可用硫酸提取铟,某研究机构对此研究的数据如下。实验中涉及的酸度(每升溶液中含硫酸的质量)与铟的浸出率的关系如图甲;硫酸溶液的体积与固体的体积比对铟浸出率的影响如图乙。 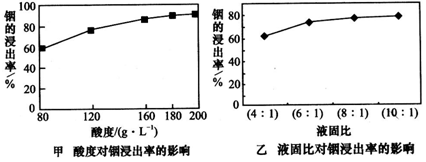

| ||
| ||
| ||

选择题答案表:
题号
1
2
3
4
5
6
7
8
答案
A
C
A
C
C
A
D
D
题号
9
10
11
12
13
14
答案
B
AD
C
D
BD
AD
15、(12分)Ⅰ(4分)①②④⑥
Ⅱ(8分)⑴用冰水冷却有利于析出更多的晶体,黑暗可以防止晶体分解(2分)
⑵过滤、洗涤(1分)
⑶100mL容量瓶、酸式滴定管(2分) (紫)红(1分) ⑷3 (2分)
 16、(8分(1)NaClO(1分)(2)
16、(8分(1)NaClO(1分)(2) (1分)
(1分)
(3)2NaCl +2H2O
 H2↑+ Cl2↑+2NaOH (2分) 氯碱工业(1分)
H2↑+ Cl2↑+2NaOH (2分) 氯碱工业(1分)
(4)2Fe3+ + 3ClO? + 10OH? = 2FeO42? + 3Cl? + 5H2O(2分)
②本身被还原成Fe3+而发生水解生成Fe(OH)3胶体吸附水中杂质以达到净化水的目的。(1分)
17、(10分)(1)FeSO4?7H2O (写FeSO4晶体也给分)
(2)防止Fe2+氧化; 取副产品甲少许溶于水,滴加适量KSCN溶液,观察溶液是否变为血红色。
(3)稀盐酸(或稀硫酸等) (4)TiO2  Ti+O2↑
(每空2分,共10分)
Ti+O2↑
(每空2分,共10分)
18、(10分)⑴2NO3-+5Mg+6H2O==N2↑+5Mg(OH)2+2OH-(2分)
⑵①快速方便易行(2分,相近合理答案也给分)
②空白对照实验(2分,相近合理答案也给分)
③将水样先稀释一定倍数后再重复实验(2分)
⑶ 800 (2分)
19、(12分)(1)加成 (1分)(2)13(2分)
(3)(4分) (4)(5分)
(4)(5分)

20、(10分)⑴ 0.01 mol?L-1(2分) 不变(1分)
⑵ <(2分)
⑶ 设焙烧炉中消耗空气的物质的量为5x,鼓风炉中消耗空气物质的量为5y,则:
 Zn(g)+CO2(g)
Zn(g)+CO2(g)
y 2y 1mol 2y×62.5% 1mol
2y×62.5%=1mol y=0.8mol 5y=4mol(2分)
2ZnS + 3O2 = 2ZnO + 2SO2 △n
2mol 1mol
1mol 0.5mol
4x/(5x-0.5mol)=82.5% x=3.3mol 5x=16.5mol(2分)
5x+5y=4mol+16.5mol=20.5mol
V(空气)=20.5×
 21、(12分)
21、(12分)
(1)CD(2分) (2) H3AsO4(1分);第四周期元素,原子核外只有四个电子层。按能量最低原理,4s上排2个电子,3d上排10个电子,4p上排6个电子,共对应18种元素,若4d排电子,就出现了第五电子层,就不是第四周期元素了,所以第四周期只有18种元素。(2分) (2)+3(1分);正四面体(1分);3d74s2(1分) (3)BC(2分)
(4)N2O或CO2或CS2或BeCl2;SCN-或OCN-(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com