
题目列表(包括答案和解析)
.
|
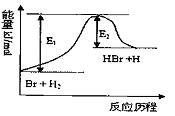 参照反应Br+H2
参照反应Br+H2 A.该反应的△H=+(E1-E2)kJ/mol
B.加入催化剂,该化学反应的反应热变大
C.反应物总能量高于生成物总能量
D.升高温度可增大正反应速率,降低逆反应速率
|
 HBr+H的能量对反应历程的示意图,下列叙述中正确的是( )
HBr+H的能量对反应历程的示意图,下列叙述中正确的是( )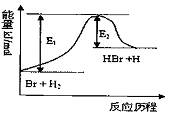
| A.该反应的△H=+(E1-E2)kJ/mol |
| B.加入催化剂,该化学反应的反应热变大 |
| C.反应物总能量高于生成物总能量 |
| D.升高温度可增大正反应速率,降低逆反应速率 |




 )?请用化学方程式表示:
)?请用化学方程式表示: +H2
+H2| 催化剂 |

 +H2
+H2| 催化剂 |

| 实验序号 | 双氧水体积 | 催化剂 | 待测数据 |
| a | 15mL | 无 | |
| b | 15mL | 0.5g CuO | |
| c | 15mL | 0.5g MnO2 |
- 4 |
 Ⅰ.下列各组物质是按一定规律排列的,请将对应的排列依据填在括号内.
Ⅰ.下列各组物质是按一定规律排列的,请将对应的排列依据填在括号内.
| ||
| ||
| ||
| ||
1.D 2.A 3.A 4.C 5.C 6.AC 7.D 8.D 9.BD 10.AB 11.B
12.D 13.B 14.B 15.A 16.B 17.B 18.B 19.A 20.B 21.C 22.D
23.(1)< (2)右侧的3处
(3)< B相当于减压了,减压后平衡向 分解的方向移动,使B中
分解的方向移动,使B中 的量减少了.
的量减少了.
24.①提高,降低;②b=4;③ ;④
;④ 或
或 或ac+bc=ab
或ac+bc=ab
25.(1)B.根据反应:

 ,
,

 ,若要充分利用原料,显然要求原料与
,若要充分利用原料,显然要求原料与 反应产生的
反应产生的 和
和 物质的量之比等于或接近于3∶1,上述反应趋于恰好反应,原料得以充分利用.
物质的量之比等于或接近于3∶1,上述反应趋于恰好反应,原料得以充分利用. w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m




(2)①

 ②不合理.因为BiOCl中,Cl的化合价为-1价.③浓NaOH溶液中,
②不合理.因为BiOCl中,Cl的化合价为-1价.③浓NaOH溶液中, 抑制
抑制 的溶解,使
的溶解,使 的浓度减小,盐酸中
的浓度减小,盐酸中 抑制
抑制 的水解.
的水解.
26.(1)2、1、3、2 (2)A为气态,B为固态或气态,D为气态 (3)放热
27.(1)按1分钟计,生成0.5 mol C产生热量45 kJ,而容器散热
 ,所以应用加热器每分钟提供热量120
kJ-45 kJ=75 kJ
,所以应用加热器每分钟提供热量120
kJ-45 kJ=75 kJ
(2)容器半径和高度都变为原来10倍,则表面变为原来1000倍,平均每分钟生成C为0.5 mol×1000=500 mol,放出热量45000kJ,而容器散热12000 kJ,所以冷却器每分钟吸收热量45000 kJ-12000 kJ=33000 kJ
(3)不变
28.a=1 b=2
29.(1) (2)1/10500 (3)10
(2)1/10500 (3)10
30.①39% ②12.5% 31.(1)① 体积
体积
②当活塞由C向B移动时,因体积扩大使平衡:

 向体积扩大方向移动以至混合气体物质的量增大.增大的物质的量可由下式求出
向体积扩大方向移动以至混合气体物质的量增大.增大的物质的量可由下式求出



起始:0.08 mol 0
平衡:

因平衡时混合气体总的物质的量为0.07 mol,由于活塞由C移至B,体积扩大,故 ,可知充入
,可知充入 物质的量必小于0.01
mol
(2)
物质的量必小于0.01
mol
(2)
 www.ks5u.com
www.ks5u.com
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com