
题目列表(包括答案和解析)
 I 取一小段镁带,用砂纸除去表面的氧化膜,放入试管中.向试管中加入2mL水,并滴入2滴酚酞试液.一会儿后发现镁带表面有气泡放出,且镁带附近溶液变红色.加热试管至水沸腾.发现镁带表面有大量气泡放出,且试管中的液体全部变为浅红色.关于该试验,下列说法正确的是
I 取一小段镁带,用砂纸除去表面的氧化膜,放入试管中.向试管中加入2mL水,并滴入2滴酚酞试液.一会儿后发现镁带表面有气泡放出,且镁带附近溶液变红色.加热试管至水沸腾.发现镁带表面有大量气泡放出,且试管中的液体全部变为浅红色.关于该试验,下列说法正确的是
 bM(g),M、N的物质的量随时间的变化曲线如右图所示:
bM(g),M、N的物质的量随时间的变化曲线如右图所示:| 1 |
| (t2-t1)×v |
| 1 |
| (t2-t1)×v |
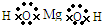

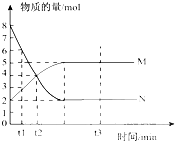
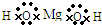
 bM(g),M、N的物质的量随时间的变化曲线如右图所示:
bM(g),M、N的物质的量随时间的变化曲线如右图所示: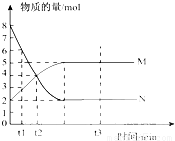
1.D 2.C 3.C 4.B 5.C 6.C 7.BC 8.BD 9.AC 10.D 11.C
12.BD 13.AC 14.A 15.B 16.D 17.B 18.D 19.B 20.D
21.D 22.C w.w.w.k.s.5.u.c.o.m
23.(1)促进,A (2)甲大
乙用氯化铵溶液稀释后,[ ]增大很多,使
]增大很多,使 的电离平衡向抑制电离的方向移动;
的电离平衡向抑制电离的方向移动; 发生水解,使稀释后的乙溶液的[
发生水解,使稀释后的乙溶液的[ ]增大
]增大
24.(1)第一种组合 A:NaOH B:
第二种组合 A: B:
B:
(2)由于 电离出
电离出 ,使水的电离平衡:
,使水的电离平衡:

 向左移动,使水的电离度小于纯水中水的电离度,而
向左移动,使水的电离度小于纯水中水的电离度,而 溶液中由于
溶液中由于


由于 电离出的
电离出的 与
与 结合生成弱电解质
结合生成弱电解质 ,从而促进水的电离,使水的电离度比纯水中的大.
,从而促进水的电离,使水的电离度比纯水中的大.
25.(1)偏高;空气中的氧气溶于样品中
(2)偏高;使 溶液浓度变低,消耗体积偏大
溶液浓度变低,消耗体积偏大
(3)偏高;使最后读取体积数比实际消耗 溶液体积数大
溶液体积数大
(4)
26.(1)增大w.w.w.k.s.5.u.c.o.m
(2)K值越大,酸性越强
(3)

(4) 上一级电离产生的
上一级电离产生的 对下一级电离有抑制作用
对下一级电离有抑制作用
(5)
27.(1) 和
和 水解均呈弱酸性,可除去金属表面的氧化物
水解均呈弱酸性,可除去金属表面的氧化物
(2) 水溶液中[
水溶液中[ ]很小,不会生成沉淀(或弱酸不能生成强酸).加入氨水时,
]很小,不会生成沉淀(或弱酸不能生成强酸).加入氨水时,

 ,使
,使 电离平衡右移,[
电离平衡右移,[ ]增大,产生沉淀(或
]增大,产生沉淀(或 与
与 生成
生成 ,使[
,使[ ]增大
]增大
(3)在HCl气流中, 抑制
抑制 水解,从而可得到
水解,从而可得到 无水物
无水物
(4)能. ,降低[
,降低[ ],其水解平衡左移,碱性减弱
],其水解平衡左移,碱性减弱
(5) 水解呈碱性,
水解呈碱性, 水解呈酸性,二者混合施用,会促进水解,大量生成易挥发的
水解呈酸性,二者混合施用,会促进水解,大量生成易挥发的 ,从而使氮肥降低肥效
,从而使氮肥降低肥效
 电离呈酸性,与
电离呈酸性,与 混合施用,会产生
混合施用,会产生 或
或 沉淀而丧失肥效.
沉淀而丧失肥效.
硫铵(即硫酸铵)水解呈酸性,长期施用土壤会板结酸化,加消石灰可调节酸度,防止板结.
28.(1)造成测定数值偏高w.w.w.k.s.5.u.c.o.m
(2)
(3)
29.(1) ;
; 、
、
(2)1.90 2.67 5.20
(3)130
分析:(1)因为在浊液中加入HCl溶液至10 mL,沉淀质量一直为 形式存在,继续加入HCl溶液,
形式存在,继续加入HCl溶液, 转变为
转变为 沉淀,加至30 mL时,
沉淀,加至30 mL时, 全部转变为
全部转变为 ,所以在A点的沉淀物为
,所以在A点的沉淀物为 ,在A至B点间,沉淀物为
,在A至B点间,沉淀物为 和
和 的混合物.当加入的HCl溶液超过30 mL时,
的混合物.当加入的HCl溶液超过30 mL时, 和
和 同时溶解.w.w.w.k.s.5.u.c.o.m
同时溶解.w.w.w.k.s.5.u.c.o.m
(2)原混合物中:
 的质量
的质量


 的质量
的质量
NaOH:
①浊液中存在的:
1×0.01 mol
② 消耗的:
消耗的:


③ 消耗的:
消耗的:

0.02 mol×4=0.08 mol
NaOH总质量
(3)从B点开始, 消耗的HCl:0.02 mol×3=0.06 mol
消耗的HCl:0.02 mol×3=0.06 mol
 消耗的HCl:0.02 mol×2=0.04 mol
消耗的HCl:0.02 mol×2=0.04 mol
所消耗HCl溶液的体积为:
Q点HCl溶液总量为:30 mL+100 mL=130 mL
30.(1)
(2)

根据 
过量 为:
为:
20.00 mL水样消耗 为
为
根据得电子数目相等,则有
相当于 为:
为:
 ,即该水样的
,即该水样的
(3)
(4)A,
 www.ks5u.com
www.ks5u.com
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com