
题目列表(包括答案和解析)
(08长沙雅礼中学一模)(16分)某课外实验小组学生利用下图所示装置进行“乙二酸(俗名草酸)晶体受热分解”的实验,并验证分解产物中有CO2和CO。(图中夹持装置已略去)
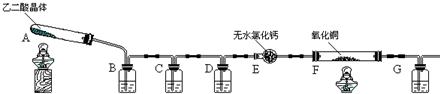 |
(1)装置C中盛放 溶液;D的作用是 ;
(2)证明分解产物中有CO的现象是 ;
(3)该装置有一个不足之处,请写出 ;
(4)某同学查阅相关资料:草酸是二元酸,酸性比碳酸强,在受热分解过程中有少量升华;草酸钙和草酸氢钙均为白色不溶物。因此该同学认为:需要在装置B之前增加一个装有________(填写下列编号字母)的洗气装置。
a.水 b.NaOH 溶液 c.Na2CO3 溶液 d.饱和NaHCO3 溶液
(5)草酸可以在酸性条件下被KMnO4氧化,反应的离子方程式为:
2MnO4- + 5H2C2O4 +6 H+ = 2Mn2+ +10 CO2↑+8 H2O
实验室常用草酸钠标定KMnO4溶液。操作如下:准确称取2.680 g草酸钠,放入锥形瓶中,加100 mL稀硫酸溶解,将锥形瓶置于 (填“酸式” “碱式”)滴定管下,用KMnO4溶液滴定。当 时,即达到滴定终点。重复上述滴定操作三次,实验数据如下表所示。
| 滴定前 | 第一次终点 | 第二次终点 | 第三次终点 | 第四次终点 |
滴定管 液面刻度 | 0.00 mL | 20.02 mL | 21.00mL | 19.98 mL | 20.00mL |
KMnO4溶液的物质的量浓度的是c(KMnO4)= mol?L-1。
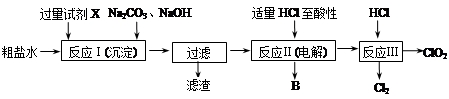
二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产ClO2的工艺主要包括:①粗盐精制;②电解微酸性NaCl溶液;③ClO2的制取。工艺流程如下图: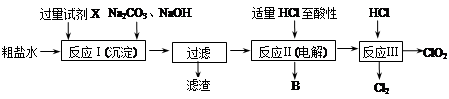
⑴ 粗食盐水中含有Ca2+、Mg2+、SO42-等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,X是 (填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO42-,其原因是 。(已知:Ksp(BaSO4)=1.1×10-10;Ksp(BaCO3)=5.1×10-9)
⑵上述过程中,将食盐水在特定条件下电解得到的氯酸钠与盐酸反应生成ClO2。电解时生成的气体B是 ;反应Ⅲ的化学方程式为 。
⑶ ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知:ClO2+I-+H+—I2+Cl-+H2O 未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知:I2+2S2O32-=2I-+S4O62-)
① 准确量取10.00 mL ClO2溶液的玻璃仪器是 。
② 滴定过程中,至少须平行测定两次的原因是 。
③ 根据上述步骤可计算出原ClO2溶液的物质的量浓度为 mol·L-1(用含字母的代数式表示)。
二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产ClO2的工艺主要包括:①粗盐精制;②电解微酸性NaCl溶液;③ClO2的制取。工艺流程如下图: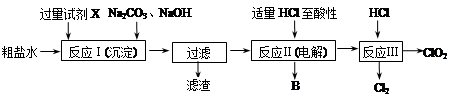
(1)粗食盐水中含有Ca2+、Mg2+、SO42-等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,X是 (填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO42-,其原因是 。(已知:Ksp(BaSO4)=1.1×10-10;Ksp(BaCO3)=5.1×10-9)
(2)上述过程中,将食盐水在特定条件下电解得到的氯酸钠与盐酸反应生成ClO2。电解时生成的气体B是 ;反应Ⅲ的化学方程式为 。
(3)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知:ClO2+I-+H+—I2+Cl-+H2O 未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知:I2+2S2O32-=2I-+S4O62-)
① 准确量取10.00 mL ClO2溶液的玻璃仪器是 。
② 滴定过程中,至少须平行测定两次的原因是 。
③ 根据上述步骤可计算出原ClO2溶液的物质的量浓度为 mol·L-1(用含字母的代数式表示)。
1.D 2.C 3.C 4.B 5.C 6.C 7.BC 8.BD 9.AC 10.D 11.C
12.BD 13.AC 14.A 15.B 16.D 17.B 18.D 19.B 20.D
21.D 22.C w.w.w.k.s.5.u.c.o.m
23.(1)促进,A (2)甲大
乙用氯化铵溶液稀释后,[ ]增大很多,使
]增大很多,使 的电离平衡向抑制电离的方向移动;
的电离平衡向抑制电离的方向移动; 发生水解,使稀释后的乙溶液的[
发生水解,使稀释后的乙溶液的[ ]增大
]增大
24.(1)第一种组合 A:NaOH B:
第二种组合 A: B:
B:
(2)由于 电离出
电离出 ,使水的电离平衡:
,使水的电离平衡:

 向左移动,使水的电离度小于纯水中水的电离度,而
向左移动,使水的电离度小于纯水中水的电离度,而 溶液中由于
溶液中由于


由于 电离出的
电离出的 与
与 结合生成弱电解质
结合生成弱电解质 ,从而促进水的电离,使水的电离度比纯水中的大.
,从而促进水的电离,使水的电离度比纯水中的大.
25.(1)偏高;空气中的氧气溶于样品中
(2)偏高;使 溶液浓度变低,消耗体积偏大
溶液浓度变低,消耗体积偏大
(3)偏高;使最后读取体积数比实际消耗 溶液体积数大
溶液体积数大
(4)
26.(1)增大w.w.w.k.s.5.u.c.o.m
(2)K值越大,酸性越强
(3)

(4) 上一级电离产生的
上一级电离产生的 对下一级电离有抑制作用
对下一级电离有抑制作用
(5)
27.(1) 和
和 水解均呈弱酸性,可除去金属表面的氧化物
水解均呈弱酸性,可除去金属表面的氧化物
(2) 水溶液中[
水溶液中[ ]很小,不会生成沉淀(或弱酸不能生成强酸).加入氨水时,
]很小,不会生成沉淀(或弱酸不能生成强酸).加入氨水时,

 ,使
,使 电离平衡右移,[
电离平衡右移,[ ]增大,产生沉淀(或
]增大,产生沉淀(或 与
与 生成
生成 ,使[
,使[ ]增大
]增大
(3)在HCl气流中, 抑制
抑制 水解,从而可得到
水解,从而可得到 无水物
无水物
(4)能. ,降低[
,降低[ ],其水解平衡左移,碱性减弱
],其水解平衡左移,碱性减弱
(5) 水解呈碱性,
水解呈碱性, 水解呈酸性,二者混合施用,会促进水解,大量生成易挥发的
水解呈酸性,二者混合施用,会促进水解,大量生成易挥发的 ,从而使氮肥降低肥效
,从而使氮肥降低肥效
 电离呈酸性,与
电离呈酸性,与 混合施用,会产生
混合施用,会产生 或
或 沉淀而丧失肥效.
沉淀而丧失肥效.
硫铵(即硫酸铵)水解呈酸性,长期施用土壤会板结酸化,加消石灰可调节酸度,防止板结.
28.(1)造成测定数值偏高w.w.w.k.s.5.u.c.o.m
(2)
(3)
29.(1) ;
; 、
、
(2)1.90 2.67 5.20
(3)130
分析:(1)因为在浊液中加入HCl溶液至10 mL,沉淀质量一直为 形式存在,继续加入HCl溶液,
形式存在,继续加入HCl溶液, 转变为
转变为 沉淀,加至30 mL时,
沉淀,加至30 mL时, 全部转变为
全部转变为 ,所以在A点的沉淀物为
,所以在A点的沉淀物为 ,在A至B点间,沉淀物为
,在A至B点间,沉淀物为 和
和 的混合物.当加入的HCl溶液超过30 mL时,
的混合物.当加入的HCl溶液超过30 mL时, 和
和 同时溶解.w.w.w.k.s.5.u.c.o.m
同时溶解.w.w.w.k.s.5.u.c.o.m
(2)原混合物中:
 的质量
的质量


 的质量
的质量
NaOH:
①浊液中存在的:
1×0.01 mol
② 消耗的:
消耗的:


③ 消耗的:
消耗的:

0.02 mol×4=0.08 mol
NaOH总质量
(3)从B点开始, 消耗的HCl:0.02 mol×3=0.06 mol
消耗的HCl:0.02 mol×3=0.06 mol
 消耗的HCl:0.02 mol×2=0.04 mol
消耗的HCl:0.02 mol×2=0.04 mol
所消耗HCl溶液的体积为:
Q点HCl溶液总量为:30 mL+100 mL=130 mL
30.(1)
(2)

根据 
过量 为:
为:
20.00 mL水样消耗 为
为
根据得电子数目相等,则有
相当于 为:
为:
 ,即该水样的
,即该水样的
(3)
(4)A,
 www.ks5u.com
www.ks5u.com
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com