
题目列表(包括答案和解析)


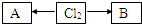 ,A、B中氯元素化合价的代数和为0,且均是共价化合物,A为强电解质,B具有漂白性,写出A→Cl2的化学反应方程式
,A、B中氯元素化合价的代数和为0,且均是共价化合物,A为强电解质,B具有漂白性,写出A→Cl2的化学反应方程式
| ||
| ||
 元素周期表中第四周期的金属元素在生产和科研中有非常重要的使用价值.
元素周期表中第四周期的金属元素在生产和科研中有非常重要的使用价值.| 元素 | A | B | C |
| 性质结构信息 | 单质在氯气中燃烧火焰呈黄色并产生大量白烟,所得产物的阳离子与D的阳离子电子数相同. | 单质是带有金属光泽的灰黑色固体,是信息技术的关键材料. | 最高价氧化物的水化物与其气态氢化物反应得到离子化合物D. |
(1)氯元素的最高价氧化物为无色液体,0.25 mol 该物质与一定量水混合得到一种稀溶液,并放出Q kJ 的热量。写出该反应的热化学方程式: 。
(2)已知:Fe2O3(s) + 3/2C(s) = 3/2CO2(g) + 2 Fe(s) ΔH =234.1 kJ·mol-1
C(s) + O2(g) = CO2(g) ΔH = —393.5 kJ·mol-1
则2 Fe(s)+ 3/2O2(g) = Fe2O3(s) 的ΔH是 kJ·mol-1。
(3)意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如下图所示。已知断裂1moIN-N吸收167kJ热量,生成1molN≡N放出942kJ。根据以上信息和数据,写出N4气体转变为N2的热化学方程式: 。
(4)下图是丙烷(C3H8)、二甲醚(CH3OCH3)燃烧过程中能量变化图,其中x为各自反应中对应的系数。根据该图写出二甲醚燃烧的热化学方程式: 。
(1)氯元素的最高价氧化物为无色液体,0.25 mol 该物质与一定量水混合得到一种稀溶液,并放出Q kJ 的热量。写出该反应的热化学方程式: 。
(2)已知:Fe2O3(s) + 3/2C(s) = 3/2CO2(g) + 2 Fe(s) ΔH =234.1 kJ·mol-1
C(s) + O2(g) = CO2(g) ΔH = —393.5 kJ·mol-1
则2 Fe(s)+ 3/2O2(g) = Fe2O3(s) 的ΔH是 kJ·mol-1。
(3)意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如下图所示。已知断裂1moIN-N吸收167kJ热量,生成1molN≡N放出942kJ。根据以上信息和数据,写出N4气体转变为N2的热化学方程式: 。

(4)下图是丙烷(C3H8)、二甲醚(CH3OCH3)燃烧过程中能量变化图,其中x为各自反应中对应的系数。根据该图写出二甲醚燃烧的热化学方程式: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com