
题目列表(包括答案和解析)
下列反应中,一定不能自发进行的是
A.2KClO3(s)= 2KCl(s)+ 3O2(g) ΔH = -78.03 kJ·mol-1,ΔS = 494.4 J·mol-1·K-1
B.CO(g)=
C(s,石墨)+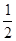 O2(g)
ΔH = 110.5
kJ·mol-1,ΔS = -89.4 J·mol-1·K-1
O2(g)
ΔH = 110.5
kJ·mol-1,ΔS = -89.4 J·mol-1·K-1
C.4Fe(OH)2(s)+2H2O(l)+O2(g)= 4Fe(OH)3(s)
ΔH = -444.3 kJ·mol-1,ΔS = -280.1 J·mol-1·K-1
D.NH4HCO3(s) + CH3COOH(aq) = CH3COONH4 (aq) + CO2(g) +H2O(l)
ΔH = 37.30 kJ·mol-1,ΔS = 184.0 J·mol-1·K-1
下列反应中,一定不能自发进行的是
A.2KClO3(s)= 2KCl(s)+ 3O2(g) ΔH = -78.03 kJ·mol-1,ΔS = 494.4 J·mol-1·K-1
B.CO(g)= C(s,石墨)+![]() O2(g) ΔH = 110.5 kJ·mol-1,ΔS = -89.4 J·mol-1·K-1
O2(g) ΔH = 110.5 kJ·mol-1,ΔS = -89.4 J·mol-1·K-1
C.4Fe(OH)2(s)+2H2O(l)+O2(g)= 4Fe(OH)3(s)
ΔH = -444.3 kJ·mol-1,ΔS = -280.1 J·mol-1·K-1
D.NH4HCO3(s) + CH3COOH(aq) = CH3COONH4 (aq) + CO2(g) +H2O(l)
ΔH = 37.30 kJ·mol-1,ΔS = 184.0 J·mol-1·K-1
下列反应中,一定不能自发进行的是
A.2KClO3(s)=2KCl(s)+ 3O2(g) ΔH = -78.03 kJ·mol-1,ΔS = 494.4 J·mol-1·K-1
B.CO(g)=C(s,石墨)+O2(g) ΔH = 110.5kJ·mol-1,ΔS = -89.4 J·mol-1·K-1
C.4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)
ΔH = -444.3 kJ·mol-1,ΔS = -280.1 J·mol-1·K-1
D.NH4HCO3(s) + CH3COOH(aq) = CH3COONH4(aq) + CO2(g) +H2O(l)
ΔH = 37.30 kJ·mol-1,ΔS = 184.0 J·mol-1·K-1
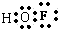
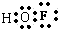
| H2 | O2 | F2 | OH | OF | HF | |
| E/(kJ/mol) | 432 | 494 | 155 | 424 | 220 | 566 |
从实验测得不同物质中O—O之间的键长和键能的数据为:
| O—O键 数据 |
|
| O2 |
|
| 键长/10-12m | 149 | 128 | 121 | 112 |
| 键能/kJ·mol-1 | x | y | z=494 | w=628 |
其中x、y的键能数据尚未测定,但可根据规律性推导键能的大小顺序为w>z>y>x。该规律性是( )
A.成键时电子数越多,键能越大 B.键长越长,键能越大
C.成键所用的电子数越少,键能越大 D.成键时电子对越偏移,键能越大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com