
题目列表(包括答案和解析)




 )?请用化学方程式表示:
)?请用化学方程式表示: +H2
+H2| 催化剂 |

 +H2
+H2| 催化剂 |


| H2 | Pd/C |


 (任写一个)
(任写一个) (任写一个)
(任写一个)

 ,请结合题中所给信息,写出由CH3CH2COOH、
,请结合题中所给信息,写出由CH3CH2COOH、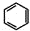 为原料合成
为原料合成 单体的第一步的合成路线和最后一步的化学方程式(无机试剂任选).
单体的第一步的合成路线和最后一步的化学方程式(无机试剂任选).

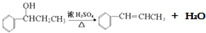
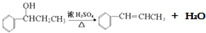
| KOH/室温 |
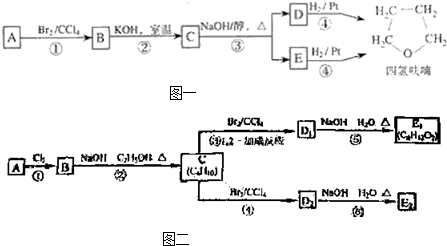
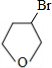





 +NaOH
+NaOH| 水 |
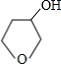 +NaBr
+NaBr +NaOH
+NaOH| 水 |
 +NaBr
+NaBr| 醇 |
| △ |
| 醇 |
| △ |


| ||
| ||
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
A
A
A
C
B
A
C
BC
D
D
AC
C
CD
AC
D
16.(一)ABDG (二)(1)温度对KIO3稳定性的影响?(或油炸食品是否适宜放碘盐)研究报告、实验报告、论文等.(2)IO3―+5I―+6H+====3I2+3H2O
17. (1)Zn-2e―==Zn2+,2MnO2+H2===Mn2O3+H2O
(3)①向小烧杯中加入一定量的热蒸馏水,充分搅拌,趁热过滤,将滤液冷却,再过滤得晶体,所得晶体即为ZnCl2、NH4Cl;②A.取少许溶液,加NaOH加热,在试管口放湿润红色石蕊试纸;B.试纸变蓝;C.NH4+OH―==NH3+H2O晶体混合物;D.取少许溶液,加……(或氨水),将悬浊液分成两份,一份加稀HCl,一份加足量氨水;E.先白色沉淀,后沉淀都溶解;③加热法;(4)坩埚、玻璃棒(三脚架、泥三角、坩埚钳等)
18.⑴排出装置中的空气(CO2、N2、H2O等);⑵AD,D;
⑶

⑷ 除去过量O2,保证最终收集的气体是反应生成的N2;
⑸水,若是气体,则不能被收集和测量,导致较大误差,充满水时能保证进入装置E的气体体积与排出水的体积基本相当;
⑹①使E、F中的液面相平;②视线与量筒内凹液面最低处相平,
⑺A B D;⑻不能,因为CO2、H2O会被碱石灰同时吸收,使实验结果缺少必要数据
19.⑴同周期从左→右电负性逐渐增大(或同主族……)
⑵2.0<x<2.4,弱;⑶得电子;⑷共价键
20.⑴还原剂;2Fe3++Fe==3Fe2+;⑵重结晶,FeSO4?7H2O;
⑶促进Ti4+完全水解生成沉淀;
| ||||||||||||||